Chuyên đề
Bệnh gút và các bệnh khớp tinh thể khác
TINH THỂ HỌC BỆNH GÚT VÀ VIÊM KHỚP
Việc sử dụng kính hiển vi phân cực trong phân tích chất lỏng hoạt dịch và các ứng dụng tinh thể học khác; chẳng hạn như kính hiển vi điện tử, phân tích nguyên tố phân tán năng lượng, nhiễu xạ tia X; đã xác định vai trò khác nhau của vi tinh thể trong viêm khớp cấp tính, mãn tính và viêm quanh khớp bao gồm monosodium urate (MSU), calcium pyrophosphate dihydrate (CPPD), calcium hydroxyapatite (HA), và calcium oxalate (CaOx). Mặc dù có sự khác biệt trong hình thái học tinh thể, hóa học và tính chất vật lý, các biểu hiện lâm sàng do lắng đọng MSU, CPPD, HA, và CaOx không thể phân biệt được (Bảng 313-1). Trước khi có kỹ thuật tinh thể học trong môn học bệnh thấp, rất nhiều viêm khớp gút do MSU nhưng trên thực tế là không phải. Simkin đã đề xuất rằng nên dùng thuật ngữ chung “Gút” để mô tả toàn bộ các nhóm viêm khớp do tinh thể (Gút MSU, gút CPPD, gút HA, và gút CaOx). Khái niệm này nhấn mạnh thêm các biểu hiện lâm sàng giống hệt nhau của các loại gút và cần phải tiến hành phân tích chất lỏng hoạt dịch để phân biệt các loại tinh thể có liên quan (Bảng 313-1). Khi có triệu chứng viêm khớp hoặc viêm quanh khớp cấp tính, chọc hút và phân tích dịch là quan trọng nhất để đánh giá khả năng nhiễm khuẩn và nhận diện loại tinh thể hiện hữu. Chỉ dùng kính hiển vi phân cực có thể nhận diện hầu hết các tinh thể điển hình và cho phép chẩn đoán. Tuy nhiên, HA là một ngoại lệ. Ngoài việc xác định chất hoặc tổ chức kết tinh đặc trưng, chất lỏng hoạt dịch là không đặc trưng, và chất lỏng hoạt dịch có thể viêm hoặc không viêm.
GÚT MONOSODIUM URATE
Gút MSU là một bệnh chuyển hóa thường ảnh hưởng từ tuổi trung niên đến tuổi già và phụ nữ sau mãn kinh. Điển hình gồm việc tích tụ axít uríc, tăng axit uric huyết, viêm khớp cấp và mãn tính theo chu kỳ, và lắng đọng tinh thể MSU tại cục sạn (tophi) mô liên kết và thận.
Viêm khớp cấp và mãn tính
Viêm khớp cấp là biểu hiện lâm sàng sớm thường gặp nhất của Gút MSU. Thông thường thì ban đầu chỉ có một khớp bị ảnh hưởng, nhưng gút cấp tính quanh khớp cũng xuất hiện ở những bệnh nhân nam giới cao huyết áp có lạm dụng rượu cũng như ở phụ nữ sau mãn kinh. Thông thường thì khớp đốt bàn chân – ngón chân của một ngón chân cái bị ảnh hưởng, nhưng khớp cổ chân, mắt cá, và đầu gối cũng thường gặp. Ở người già, khớp ngón tay có thể bị viêm. Các nút Heberden hoặc Bouchard viêm có thể là biểu hiện đầu tiên của viêm khớp gút. Thời kỳ đầu của viêm khớp gút cấp tính thường bắt đầu vào ban đêm với đau khớp nặng và sưng khớp. Khớp nhanh chóng trở nên nóng, đỏ, và mềm, và thường biểu hiện trên lâm sàng giống viêm mô tế bào. Tổn thương ban đầu có xu hướng tự giảm sau 3-10 ngày, và hầu hết các bệnh nhân đều không để lại di chứng tới chu kỳ kế tiếp. Một vài trường hợp có thể làm viêm khớp gút cấp tới sớm hơn: chế độ ăn kiêng quá nhiều, chấn thương, phẫu thuật, uống rượu nhiều, hóc-môn hướng vỏ thượng thận (ACTH), ngưng dùng glucocorticoid, điều trị giảm axít uríc huyết, các bệnh nặng như nhồi máu cơ tim và đột quỵ.
Sau nhiều cơn cấp tính một hoặc một vài khớp, một số bệnh nhân gút có biểu hiện của viêm màng hoạt dịch mãn tính không đối xứng, có thể nhầm với viêm khớp dạng thấp. Ít gặp hơn, chỉ có biểu hiện viêm khớp gút mãn tính, và hiếm gặp hơn nữa, bệnh biểu hiện với cục lắng đọng quanh khớp có viêm hoặc không viêm và không có viêm màng hoạt dịch mãn tính. Phụ nữ chiếm từ 5-17% trong tổng số bệnh nhân gút. Gút sau mãn kinh hiếm gặp và chỉ chiếm 17% trong tổng số phụ nữ bị gút, chỉ gặp trong các gia đình có tiền sử bị gút. Vài trăm trường hợp gút sớm gặp ở phụ nữ trẻ do giảm độ thanh thải urat của thận và suy thận đã được mô tả. Phụ nữ sau mãn kinh và người già bị viêm khớp gút thì hầu hết có tăng huyết áp động mạch gây suy thận nhẹ và có điều trị lợi tiểu. Hầu hết các bệnh nhân này cũng có bệnh thoái hóa khớp và các cục sạn viêm lắng đọng tại các nút Heberden và Bouchard.
CHẨN ĐOÁN CẬN LÂM SÀNG
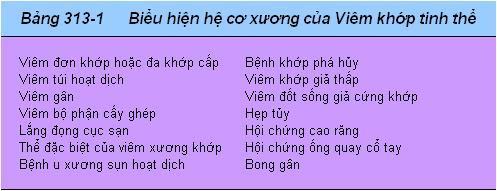
Dù biểu hiện gút rất rõ trên lâm sàng, chẩn đoán nên được xác định bằng chọc hút khớp viêm cấp hoặc mãn tính hoặc cục sạn. Viêm khớp cấp nhiễm trùng, một vài bệnh khớp tinh thể khác, thấp khớp hồi quy, viêm khớp vảy nến có thể có các đặc điểm lâm sàng tương tự. Trong các cơn gút cấp, các tinh thể MSU hình kim có lưỡng chiết quang mạnh với hệ số giãn âm tính có rất nhiều trong tế bào (Hình 313-1). Đếm tế bào chất lỏng hoạt dịch thấy cao từ 2000 đến 60000/µL. Dịch xuất hiện đục do bạch cầu, và số lượng lớn tinh thể đôi khi sản sinh ra dịch khớp bột hoặc sền sệt. Nhiễm khuẩn có thể cùng tồn tại với tinh thể urat trong chất lỏng hoạt dịch; nếu có bất cứ nghi ngờ khớp nhiễm trùng, phải cấy dịch khớp. Tinh thể MSU thường thấy đầu tiên ở khớp đốt xương bàn chân và ở đầu gối không có gút cấp. Chọc khớp trên những khớp này là một kỹ thuật hữu ích để chẩn đoán giữa các cơn gút. Nồng độ axít uric huyết tương có thể bình thường hoặc thấp trong cơn gút cấp, khi nồng độ axít uric giảm do điều trị giảm axít uric hoặc do dùng thuốc, đã làm giảm giá trị chẩn đoán xác định bằng nồng độ axít huyết tương. Mặc dù hạn chế như vậy, axít uric huyết tương luôn luôn cao tại một thời điểm nào đó và có thể được sử dụng để theo dõi giai đoạn điều trị giảm axít uric. Một tập hợp kết quả axít uric 24h rất có giá trị trong việc đánh giá nguy cơ sỏi, trong việc giải thích sự quá sản hoặc giảm tiết axít uric, và trong quyết định sử dụng phác đồ giảm axít uric nào. Bài tiết quá 800mg axít uric mỗi 24h trên bệnh nhân ăn kiêng thường xuyên thì nên nghi ngờ nguyên nhân do quá sản purine. Nên phân tích nước tiểu, nitơ urê máu, creatinine huyết tương, đếm tế bào máu trắng (WBC), lipít huyết tương vì khả năng di chứng bệnh gút và các bệnh phối hợp khác cần điều trị.
ĐẶC ĐIỂM X-QUANG
Thay đổi nang, mòn rõ được mô tả như các tổn thương phân hủy thành lỗ với các đầu xương nhô ra (dấu hiệu Martel hoặc dấu hiệu G (G viết tắt của Gút), kết hợp với các khối can-xi hóa mô mềm là các đặc điểm X-quang đặc trưng của gút mãn tính có cục sạn. Tuy nhiên, các dấu hiệu x-quang tương tự cũng có thể thấy trong bệnh viêm khớp thể ăn mòn, bệnh khớp phá hủy do Apatít, viêm khớp dạng thấp.
ĐIỀU TRỊ
Viêm khớp dạng gút cấp
Điều trị căn bản trong cơn gút cấp là dùng thuốc chống viêm như colchicine, kháng viêm không steroit (NSAIDs), hoặc glucocorticoid, tùy thuộc vào độ tuổi và điều kiện bệnh phối hợp. Cả colchicine và kháng viêm không steroit có thể độc với người già, đặc biệt khi có suy thận và rối loạn dà dày – ruột. Ở bệnh nhân cao tuổi, ta có thể dùng tiêm glucocorticoid nội khớp ở một hoặc hai khớp lớn hoặc dùng túi chườm đá cùng với uống colchicine liều thấp đối với viêm màng hoạt dịch dạng gút ảnh hưởng đến khớp nhỏ. Colchicine đường uống là cách dùng truyền thống và có hiệu quả trong ít nhất 85% bệnh nhân nếu sử dụng sớm trong cơn cấp tính. Dùng một viên nén (0,6 mg) cho mỗi giờ đến cho đến khi giảm triệu chứng hoặc xuất hiện nhiễm độc dạ dày – ruột, hoặc dùng tổng cộng bốn đến tám viên nén theo độ tuổi bệnh nhân. Phải dừng thuốc ngay khi có dấu hiệu đầu tiên là phân lỏng và phải điều trị triệu chứng ngay khi tiêu chảy. Colchicine đường tĩnh mạch đôi khi được sử dụng và có thể giảm bớt, mặc dù không loại trừ hết, các tác dụng phụ dạ dày – ruột. Colchicine đường tĩnh mạch chắc chắn được sử dụng dự phòng trước hoặc sau phẫu thuật với liều 1 tới 2 mg khi mà bệnh nhân không thể dùng đường uống. Nhiễm độc colchicine có nguy cơ tử vong hoặc đột tử với liều hơn 4 mg/ngày đường tĩnh mạch. Liều tiêm tĩnh mạch trong viêm khớp gút cấp tính là 1 đến 2 mg truyền tĩnh mạch chậm trên 10 phút qua bộ truyền dịch có điều chỉnh, và có thể dùng thêm hai liều, mỗi liều 1 mg cách nhau 6 giờ, nhưng tổng liều không bao giờ được vượt quá 4 mg. Kháng viêm không steroit có hiệu quả trong khoảng 90% bệnh nhân, và các triệu chứng và dấu hiệu giảm đi sau 5 – 7 ngày. Những thuốc có tác dụng nhất và có thời gian bán hủy ngắn nhất bao gồm indomethacin, 25 đến 50 mg tid, ibuprofen, 800 mg tid, hoặc diclofenac, 50 mg tid. Chất ức chế chọn lọc cao Cyclooxigenase-2 có tác dụng tương tự nhưng ít nhiễm độc ngắn hạn cho dạ dày – ruột hơn. Thuốc glucocorticoid đường uống, chẳng hạn như prednisone, liều ban đầu là 30 đến 50 mg/ngày rồi giảm dần trong 5 đến 7 ngày, một liều methylprednisolone tiêm tĩnh mạch duy nhất 7mg betametasone, hoặc 20 đến 40 mg triamcinolone acetonide tiêm nội khớp đều cho hiệu quả tương tự. ACTH tiêm bắp 40 đến 80 IU một liều duy nhất mỗi 12 giờ trong 1 đến 2 ngày có hiệu quả ở bệnh nhân gút đa khớp cấp tính dai dẳng có chống chỉ định với colchicine hay kháng viêm không steroit.
Điều trị giảm axít uric huyết tương
Cố gắng làm nồng độ axít uric về mức bình thường dưới 300 µmol/L (5.0 mg/dL) để phòng ngừa cơn gút tái phát và loại bỏ sự lắng đọng cục sạn đòi hỏi phải cam kết thực hiện theo phác đồ giảm axít uric dài hạn và nói chung là dùng thuốc suốt đời. Cần xem xét liệu pháp điều trị giảm axít uric khi chứng tăng axít uric không thể chữa bằng các phương pháp đơn giản (kiểm soát cân nặng, chế độ ăn ít purine, tăng tiêu thụ chất lỏng, hạn chế uống rượu, và tránh sử dụng thuốc lợi tiểu). Thông thường thì quyết định bắt đầu điều trị giảm axít uric khi cân nhắc đến số lượng các cơn cấp tính, tiền sử gia đình bị gút, sự hiện diện của cục sạn MSU lắng đọng, bài tiết axít uric quá 800 mg trong 24 giờ, sự hiện diện của sỏi axít uric và những nguy cơ bệnh thận axít uric cấp tính trong thời gian hóa trị đối với các rối loạn tăng sinh tủy xương. Thuốc gây axit uric niệu, chẳng hạn như probenecid, có thể được sử dụng ở bệnh nhân chức năng thận còn tốt, những người bài tiết ít axít uric, dưới 600 mg trong 24h mẫu nước tiểu. Phải duy trì thể tích nước tiểu bằng uống 1500 ml nước mỗi ngày. Có thể bắt đầu dùng probenecid liều 200 mg hai lần trong ngày và tăng dần khi cần thiết lên tới 2 g để duy trì nồng độ axít uric dưới 300 µmol/L (5.0 mg/dL). Thuốc probenecid được lựa chọn để điều trị bệnh nhân cao tuổi có tăng huyết áp phụ thuộc thiazide, tuy nhiên, probenecid không có hiệu quả khi độ thanh thải creatinine niệu dưới 1mL/giây. Những bệnh nhân này có thể phải cần tới thuốc allopurinol hoặc benzbromarone (không có sẵn ở Hoa Kỳ), đó là một thuốc gây axit uric niệu khác có tác dụng trên bệnh nhân suy thận và những người đang điều trị thuốc lợi tiểu. Allopurinol là thuốc tốt nhất để giảm urat huyết tương trong quá sản, tạo sỏi và bệnh nhân có suy thận từ trước. Dùng một liều duy nhất vào buổi sáng, ban đầu liều 300 mg và tăng lên tới 800 mg nếu cần. Không nhất thiết phải bắt đầu liều thấp ở hầu hết các bệnh nhân, tuy nhiên, ở những bệnh nhân suy thận, liều dùng nên được điều chỉnh dựa trên sự cô đặc của creatinine huyết tương để giảm thiểu tác dụng phụ. Những bệnh nhân thường xuyên có cơn cấp tính thì cần liều bắt đầu thấp để phòng ngừa bệnh trầm trọng thêm. Nhiễm độc allopurinol thấy tăng ở những bệnh nhân suy thận sử dụng thuốc lợi tiểu thiazide, và ở những bệnh nhân dị ứng với peniciline và ampiciline. Tác dụng phụ nghiêm trọng nhất bao gồm phát ban trên da tiến triển tới hoại tử da nhiễm độc có nguy cơ tử vong, viêm mạch toàn thân, suy tủy xương, viêm gan thể hạt, và suy thận. Thuốc hạ urat không nên sử dụng trong các cơn cấp tính. Điều này đặc biệt quan trọng ở bệnh nhân có viêm khớp cấp dai dẳng hoặc những người đã có vấn đề trước đó với thuốc giảm axít uric. Tiếp tục dự phòng colchicine liều 0,6 mg một đến hai lần mỗi ngày cùng với điều trị giảm axít uric cho đến khi bệnh nhân có nồng độ axít uric trở về bình thường và không có cơn gút cấp trong vòng 3 tháng. Tuy nhiên, dự phòng bằng colchicine có thể cần thiết chừng nào cục sạn còn tồn tại. Kết hợp urate-oxidase không tái tổ hợp (uricase) có thể được sử dụng trong dự phòng ngắn hạn và điều trị tăng axít uric phối hợp hóa trị ở những bệnh nhân tăng sinh mô bạch huyết và rối loạn tăng sinh tủy xương.
BỆNH LẮNG ĐỌNG CPPD
Bệnh học
Sự lắng đọng tinh thể CPPD trong mô khớp phổ biến nhất ở người già, ảnh hưởng từ 10 đến 15% người từ 65 đến 75 tuổi và 30 – 60% người trên 85 tuổi. Trong hầu hết các trường hợp thì quá trình này không có triệu chứng, và nguyên nhân lắng đọng CPPD chưa rõ. Bởi vì có hơn 80% bệnh nhân có tuổi trên 60 và 70% có tổn thương khớp từ trước do bệnh khác, có khả năng là do thay đổi sinh hóa trong lão hóa sụn thúc đẩy quá trình tạo kết tinh. Ví dụ về những thay đổi hóa học đó như sau. Có một gia tăng sản xuất pyrophosphate ngoại lai và giảm nồng độ pyrophosphatases trong sụn chiết xuất từ bệnh nhân có viêm khớp CPPD. Tình trạng này, trong đó tăng pyrophosphate ngoại lai và thúc đẩy hình thành tinh thể CPPD, có thể cũng ngăn cản việc hình thành hydroxyapatite. Việc tăng sản xuất pyrophosphate dường như liên quan đến việc tăng cường hoạt động của ATP pyrophosphohydrolase và 5’-nucleotodase, khi đó nó xúc tác phản ứng ATP tạo sdenosine và pyrophosphate. Pyrophosphate này có thể kết hợp với canxi để tạo thành tinh thể CPPD trong túi matrix hoặc trên sợi collagen. Có giảm nồng độ glycosaminoglycans sụn mà bình thường ức chế hoặc điều tiết việc kết tinh. Những thiếu hụt này có thể dẫn đến tăng lắng đọng tinh thể. Nghiên cứu trong phòng thí nghiệm đã chứng tỏ rằng cả hai yếu tố tăng trưởng là yếu tố tăng trưởng biến đổi β và yếu tố tăng trưởng biểu bì kích thích sản sinh ra pyrophosphate của sụn khớp và do đó gây ra lắng đọng các tinh thể CPPD. Tiếp theo việc giải phóng tinh thể CPPD vào khớp là việc thực bào các tinh thể này bởi bạch cầu trung tính, đáp ứng bằng cách giải phóng các chất viêm. Ngoài ra, bạch cầu trung tính còn giải phóng glycopeptide gây hóa ứng động các bạch cầu trung tính khác, vì vậy, tăng tình trạng viêm. Chất tương tự cũng hiện diện trong gút MSU.
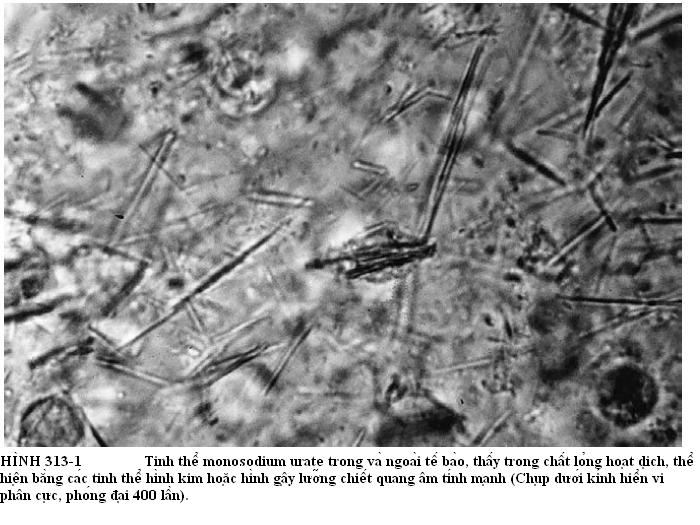
Một số ít bệnh nhân bệnh khớp CPPD có bất thường về chuyển hóa hoặc bệnh CPPD di truyền (Bảng 313-2). Sự kết hợp này gây nghi ngờ rằng một số sản phẩm chuyển hóa khác nhau có thể gây lắng đọng CPPD. Trong các bệnh thì gồm bốn bệnh “chữ H” là chứng tăng năng tuyến cận giáp (hyperparathyroidism), bệnh nhiễm sắc tố sắt mô (hemochromatosis), giảm photphataza (hypophosphatasia), chứng giảm magne huyết (hypomagnesemia). Bệnh nhiễm sắc tố sắt mô và chứng tăng năng tuyến cận giáp là những ví dụ điển hình. Các ion sắt và chứng tăng canxi huyết có thể tác dụng trực tiếp trên sụn hoặc ức chế pyrophosphatases nội sinh, dẫn đến tăng độ nhạy trong lắng đọng CPPD. Sự hiện diện viêm khớp CPPD ở người dưới 50 tuổi thì nên xem xét các rối loạn chuyển hóa này và các thể bệnh di truyền, bao gồm những bệnh đã xác định ở những nhóm chủng tộc thiểu số khác nhau (Bảng 313-2). Các nghiên cứu ADN gen trên năm trăm trường hợp đã chỉ ra vị trí di truyền khuyết tật trên nhiễm sắc thể 8q ở một trăm trường hợp và trên nhiễm sắc thể 5p trong bốn trăm trường hợp còn lại thể hiện gen của ống màng pyrophosphate (ANK gene). Một gen khuyết tật được mô tả trên chuột gây tăng pyrophosphate trong tế bào và giảm pyrophosphate ngoài tế bào và thúc đẩy lắng đọng apatít. Biến đổi được mô tả trên gen ANK ở người trong bốn trăm trường hợp viêm khớp CPPD có thể tăng pyrophosphate ngoài tế bào và hình thành tinh thể CPPD (Hình 313-2). Nhận dạng các gen này giúp làm sáng tỏ về bệnh học của cả hai thể bệnh thuộc gia đình và thể không đặc thù thường gặp hơn. Nên điều tra tìm những bằng chứng kết hợp có tính chất gia đình và đánh giá canxi huyết tương, phốt pho, photphataza kiềm, ma-nhê, ferritin huyết tương, và transferritin bão hòa.

Biểu hiện lâm sàng
Bệnh khớp CPPD có thể biểu hiện không triệu chứng, cấp tính, bán cấp hoặc mãn tính hoặc gây ra viêm màng hoạt dịch cấp trên khớp mạn tính. Ban đầu, viêm khớp CPPD cấp được McCarty và cộng sự gọi là giả gút vì biểu hiện tương tự gút. Các biểu hiện lâm sàng khác của lắng đọng CPPD bao gồm (1) xuất hiện hoặc tăng viêm xương khớp thể đặc trưng; (2) xuất hiện bệnh phá hủy nặng mà chụp X-quang rất giống viêm khớp thần kinh; (3) viêm màng hoạt dịch quá sản đối xứng, lâm sàng biểu hiện giống viêm khớp dạng thấp và thường thấy trong các thể gia đình với biểu hiện ban đầu rất sớm; (4) can-xi hóa dây chằng và đĩa gian đốt làm giới hạn cử động cột sống, giống viêm cứng khớp đốt sống (còn được thấy trong các thể di truyền) và (5) hiếm khi hẹp tủy sống (thường thấy trong người cao tuổi) (Bảng 313-1).
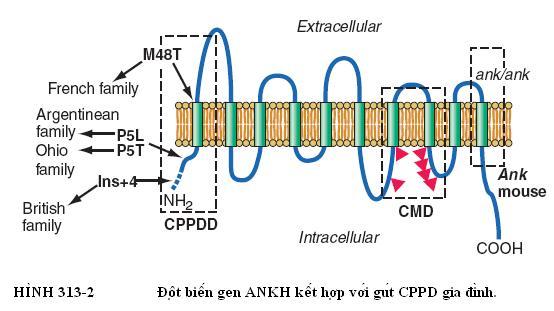
Khớp gối là khớp thường xuyên bị ảnh hưởng nhất trong bệnh khớp CPPD. Các nơi khác bao gồm cả cổ tay, vai, mắt cá, khuỷu tay, và bàn tay. Hiếm gặp ở khớp thái dương hàm và dây chằng vòng của ống tủy sống. Bằng chứng lâm sàng và X-quang cho thấy lắng đọng CPPD ở đa khớp chiếm đến hai phần ba tổng số bệnh nhân. Khi hình ảnh lâm sàng giống viêm xương khớp tiến triển chậm thì khó chẩn đoán hơn. Sự phân bố khớp có thể cung cấp những đầu mối quan trọng nghi ngờ bệnh CPPD. Ví dụ, viêm xương khớp nguyên phát hiếm khi gặp ở xương đốt bàn tay – ngón tay, cổ tay, khuỷu tay, vai hoặc khớp mắt cá. Nếu hình ảnh X-quang thể hiện lắng đọng tập trung tia từng chấm hay dạng đường thẳng tại sụn chêm khớp xơ sụn hoặc sụn khớp trong suốt (Chứng vôi hóa sụn khớp), thì chẩn đoán CPPD chắc chắn thêm. Chẩn đoán xác định đòi hỏi phải có hiện diện tinh thể điển hình trong chất lỏng hoạt dịch hoặc mô khớp (Hình 313-3). Nếu không có dịch tiết khớp hoặc chỉ định tiến hành sinh thiết hoạt dịch, chứng vôi hóa sụn khớp nghi ngờ do lắng đọng CPPD. Một trường hợp ngoại lệ là chứng vôi hóa sụn khớp do CaOx ở một số bệnh nhân có suy thận mãn tính.
Các cơn viêm khớp CPPD cấp có thể xuất hiện sớm hơn do chấn thương, soi khớp hay tiêm hyaluronate. Giảm nhanh nồng độ can-xi huyết tương, có thể xảy ra trong bệnh nặng hoặc sau phẫu thuật (đặc biệt là phẫu thuật cắt bỏ tuyến cận giáp), có thể dẫn đến các cơn giả gút.
Trong khoảng 50% các trường hợp, gút CPPD có kèm theo sốt nhẹ và đôi khi nhiệt độ lên tới 40oC. Cho dù có hoặc không có bằng chứng X-quang về chứng vôi hóa sụn khớp tại các khớp liên quan, thì việc phân tích hoạt dịch với cấy vi khuẩn là cần thiết để loại trừ khả năng nhiễm khuẩn. Trên thực tế, nhiễm trùng khớp khi có bất cứ quá trình lắng đọng tinh thể nào có thể dẫn đến rơi tinh thể và viêm màng hoạt dịch xuất hiện sau do cả hai yếu tố tinh thể và vi sinh. Chất lỏng hoạt dịch trong gút CPPD cấp có biểu hiện viêm. Đếm tế bào máu trắng (WBC) kết quả từ vài ngàn tế bào đến 100.000 tế bào/µL, trung bình là 24.000 tế bào/µL và phần lớn là bạch cầu trung tính. Kính hiển vi phân cực thường phát hiện ra các tinh thể hình thoi với lưỡng chiết quang dương tính yếu trong các cục sợi fibrim và trong các bạch cầu trung tính (Hình 313-3).
ĐIỀU TRỊ
Những cơn cấp tính không điều trị có thể kéo dài vài ngày tới một tháng. Điều trị bằng chọc hút khớp và thuốc kháng viêm không có steroit (NSAID), hoặc colchicine, hoặc tiêm glucocorticoit nội khớp có thể có hiệu quả làm quay trở lại tình trạng trước đó trong vòng dưới 10 ngày. Đối với bệnh nhân hay tái phát cơn CPPD cấp, điều trị dự phòng hàng ngày colchicine với liều thấp có thể làm giảm tần số xuất hiện cơn tái phát. Các cơn đa khớp nặng thường cần dùng glucocorticoit ngắn hạn. Thật không may, không có cách nào để lấy đi các lắng đọng CPPD tại sụn và màng hoạt dịch. Các nghiên cứu chưa được kiểm chứng đề xuất rằng cắt bỏ màng hoạt dịch bằng phóng xạ (với yttrium 90) hoặc dùng thuốc chống sốt rét có hiệu quả kiểm soát viêm màng hoạt dịch dai dẳng. Bệnh nhân có bệnh phá hủy khớp tiến triển tại khớp lớn đòi hỏi phải thay khớp.
BỆNH LẮNG ĐỌNG CALCIUM HYDROXYAPATITE
Bệnh học
Hydroapatite (HA) là chất chủ yếu cấu tạo nên xương và răng. Tích lũy bất thường có thể xảy ra trong mô bị tổn thương (canxi hóa do loạn dưỡng), trong tăng canxi huyết hoặc tình trạng tăng năng tuyến cận giáp (canxi hóa do di căn), và trong một số tình trạng chưa rõ nguyên nhân (Bảng 313-3). Trong suy thận mãn tính, tăng phốt-phát huyết làm tăng lắng đọng HA cả trong và quanh khớp. Hiếm gặp tập hợp mang tính gia đình, nhưng cho đến nay không có kết hợp với biến dị ANK người được trình bày.
HA có thể thoát ra từ xương và gây ra viêm màng hoạt dịch cấp tính đôi khi thấy trong viêm xương khớp mãn tính ổn định (ví dụ, các nốt Heberden). Lắng đọng HA cũng là một yếu tố quan trọng trong bệnh khớp phá hủy nặng mãn tính ở người cao tuổi mà xảy ra thường xuyên nhất ở đầu gối và vai (vai Milwaukee). Phá hủy khớp cộng với giảm hoặc mất kết cấu đỡ dẫn đến mất ổn định và biến dạng. Tiến triển bệnh có xu hướng âm thầm, và đếm tế bào máu trắng WBC trong chất lỏng hoạt dịch thường dưới 2.000 tế bào/µL. Triệu chứng đau có thể từ nhẹ đến rất nặng và mất chức năng có thể phải phẫu thuật thay khớp. Một phản ứng của mô màng hoạt dịch với tinh thể HA thường biểu hiện ở viêm xương khớp thì không rõ ràng ngay cả khi bệnh nhân có biểu hiện nặng. Cấy mô màng hoạt dịch tìm tinh thể HA (hoặc CPPD) thấy tăng đáng kể việc giải phóng colagenaza và proteaza trung tính, tập trung ở các tế bào lót màng hoạt dịch bị kích thích bất thường có khả năng phá hủy.

Biểu hiện lâm sàng
Lắng đọng khớp và quanh khớp có thể cùng tồn tại và kết hợp với các tổn thương cấp hoặc mãn tính đối với bao khớp, gân, túi hoạt dịch, và bề mặt khớp. Vị trí HA lắng đọng thường gặp nhất bao gồm túi và gân trong và quanh đầu gối, vai, hông và ngón tay. Biểu hiện lâm sàng bao gồm các bất thường X-quang không có triệu chứng, viêm màng hoạt dịch cấp, viêm túi hoạt dịch, viêm gân, và bệnh khớp phá hủy mãn tính. Hầu hết các bệnh nhân bệnh khớp HA là người cao tuổi. Mặc dù không rõ tỷ lệ mắc bệnh viêm khớp HA, nhưng 30 – 50% bệnh nhân viêm xương khớp có tinh thể HA trong chất lỏng hoạt dịch. Những tinh thể đó có thể thấy thường xuyên trong những khớp bị viêm xương khớp mãn tính đã ổn định, nhưng phải chú ý đến những người đã bị đau khớp và sưng khớp cấp và bán cấp nặng. Đếm tế bào máu trắng WBC trong chất lỏng hoạt dịch ở viêm khớp HA thường thấp (<2.000 tế bào/µL) nhưng nhiều trường hợp tới 50.000 tế bào/µL. Hầu hết các phân tích chất lỏng hoạt dịch đều thể hiện tập trung nhiều số lượng bạch cầu đơn nhân. Đôi khi, bạch cầu trung tính chiếm ưu thế.
Chẩn đoán
Không thể chẩn đoán bệnh khớp HA bằng chụp X-quang. Có thể thấy can-xi hóa trong và quanh khớp có kèm hoặc không kèm theo các biến đổi dạng mòn, phá hủy hay phì đại.
Chẩn đoán xác định bệnh khớp HA dựa vào sự hiện diện của tinh thể trong chất lỏng hoạt dịch hoặc trong mô (Hình 313-4). Các tinh thể thì rất nhỏ, không lưỡng chiết quang, và có thể nhìn thấy bằng kính hiển vi điện tử. Các bó tinh thể biểu hiện như những hạt sáng từ 1 – 20 µm trong hoặc ngoài tế bào có màu đỏ tía khi nhuộm bằng thuốc nhuộm Wright và có màu đỏ sáng khi nhuộm bằng alizarin red S. Chẩn đoán xác định tuyệt đối thì phụ thuộc vào kính hiển vi điện tử kèm theo phân tích nguyên tố phân tán năng lượng, nhiễu xạ tia X, hoặc kính hiển vi hồng ngoại.
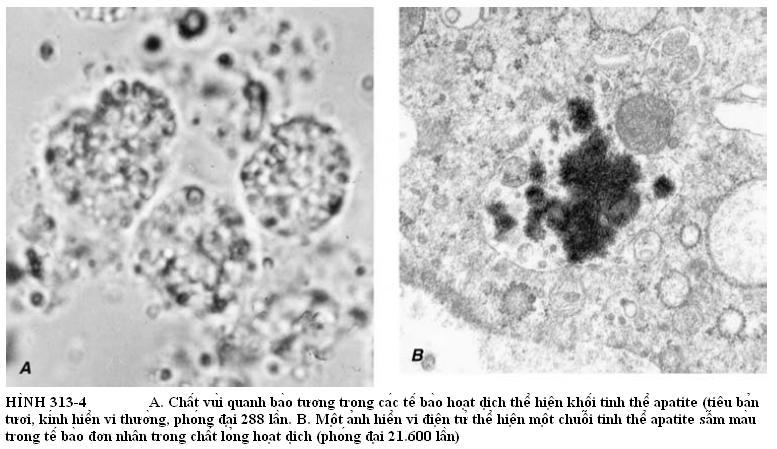
ĐIỀU TRỊ
Điều trị viêm khớp HA là không đặc hiệu. Các cơn cấp của viêm túi hoạt dịch hoặc viêm màng hoạt dịch có thể tự giảm trong vòng một vài ngày đến vài tuần. Hút dịch tiết và việc sử dụng chất chất kháng viêm không steroit hoặc uống colchicine trong 2 tuần hoặc tiêm muối glucocorticoit nội khớp hoặc quanh khớp có thể rút ngắn thời gian và mức độ của các triệu chứng. Trong các bệnh nhân có biến dạng khớp phá hủy nặng thì đáp ứng đối với điều trị không đáng kể.
BỆNH LẮNG ĐỌNG CaOx
Bệnh học
Loạn chuyển hóa oxalat nguyên phát là bệnh rối loạn chuyển hóa di truyền hiếm gặp. Sản xuất axit oxalic có thể do khiếm khuyết ít nhất là từ hai men khác nhau, dẫn đến tăng oxalat huyết và lắng đọng các tinh thể calci oxalat trong mô. Chứng nhiễm calci thận, suy thận, và tử vong xảy ra trước tuổi 20. Viêm khớp và viêm quanh khớp cấp và/hoặc mãn tính CaOx có thể là biến chứng từ loạn chuyển hóa oxalat từ những năm bệnh tật trước đó.
Loạn chuyển hóa oxalat thứ phát thường gặp hơn nguyên phát. Nó là một trong những rối loạn chuyển hóa thường gặp gây biến chứng bệnh thận giai đoạn cuối (end-stage renal disease – ESRD). Trong bệnh thận giai đoạn cuối, lắng đọng calci oxalat đã được phát hiện từ lâu ở các cơ quan nội tạng, mạch máu, xương và thậm chí ở sụn. Tuy nhiên, phải tới năm 1982 mới chứng minh được sự lắng đọng đó là một trong những nguyên nhân gây viêm khớp trong suy thận mãn tính. Cho đến nay, các bệnh nhân đã được báo cáo là phụ thuộc vào sự thẩm tách máu (lọc máu) kéo dài hoặc thẩm tách màng bụng (lọc màng bụng) và rất nhiều bệnh nhân đã dùng axit ascorbic bổ xung. Axit ascorbic được chuyển hóa thành oxalat, không trong sạch hoàn toàn trong urê huyết và trong thẩm tách. Ngày nay, những bổ xung đó thường được tránh trong chương trình thẩm tách vì có nguy cơ tăng oxalat huyết và các di chứng của nó.
Biểu hiện lâm sàng và chẩn đoán
Như lưu ý cho các muối calci khác, khối CaOx có thể tìm thấy trong xương, sụn khớp, màng hoạt dịch, và mô quanh khớp. Từ những vị trí này, các tinh thể có thể rơi rụng, gây viêm màng hoạt dịch cấp tính. Giống như HA và CPPD, các khối CaOx thường trực có thể kích thích tăng sản hoạt dịch và giải phóng các men, dẫn đến tiến triển phá hủy khớp. Sự lắng đọng đã được ghi nhận ở ngón tay, cổ tay, khuỷu tay, đầu gối, mắt cá, và bàn chân.
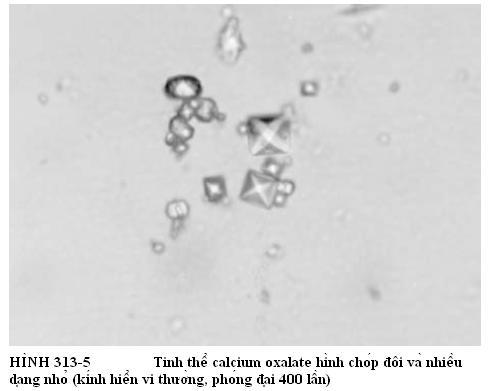
Mỗi một thể bệnh khớp tinh thể có thể là biến chứng của bệnh thận giai đoạn cuối, và hiếm khi có bệnh nhân có nhiều hơn một loại tinh thể trong dịch tiết. Kỹ thuật tinh thể học đã chứng minh rõ ràng là hầu hết các vấn đề viêm khớp trong bệnh thận giai đoạn cuối không phải là do gút MSU mà trước đây mọi người vẫn tưởng vậy. Đặc tính lâm sàng của viêm khớp CaOx cấp có thể không phân biệt được với các triệu chứng của natri urat, CPPD hay HA. Chụp X-quang có thể thấy vôi hóa sụn khớp, một đặc trưng của lắng đọng CPPD hoặc CaOx. Dịch tiết hoạt dịch chứa CaOx thường không viêm, với số lượng tế bào bạch cầu <2.000/µL. Bạch cầu trung tính hoặc bạch cầu đơn nhân chiếm đa số. Tinh thể CaOx có nhiều hình dạng khác nhau và có lưỡng chiết quang thay đổi theo ánh sáng phân cực. Hình dạng dễ nhận thấy nhất ở dạng hình chóp đôi, có lưỡng chiết quang dương tính mạnh (Hình 313-5).
ĐIỀU TRỊ
Điều trị bệnh khớp CaOx bằng thuốc kháng viêm không steroit, cochicine, glucocorticoit nội khớp, và/hoặc kèm theo tăng tần số thẩm tách có hiệu quả chút ít. Trong loạn chuyển hóa oxalat nguyên phát, ghép gan có tác dụng giảm đáng kể lắng đọng tinh thể.
Dịch từ nguyên bản tiếng Anh - Gout and other crystals arthropathies, Antonio J. Reginato, Harrison’s Principle of Internal Medicine, 16th Edition bởi healthconsul@gmail.com tại Dulichchuabenh.vn
Tải xuống bản pdf đầy đủ