Chuyên đề
Các khối u nguyên phát và di căn của hệ thần kinh - STEPHEN M. SAGAR & MARK A. ISRAEL
Các khối u nguyên phát ác tính của hệ thần kinh trung ương (TKTU) xảy ra trên khoảng 16.500 người với tỷ lệ tử vong hàng năm xấp xỉ 13.000 người tại Hoa Kỳ, khoảng 6/100.000. Tỷ lệ theo lứa tuổi cũng phù hợp với tỷ lệ trên toàn thế giới. Một tỷ lệ tương đương u lành tính được phát hiện nhưng tỷ lệ tử vong thấp hơn nhiều. Các khối u tế bào đệm chiếm 50-60% trong tổng số các khối u não nguyên phát, u màng não chiếm 25%, u bao sợi thần kinh chiếm 10% và còn lại là các khối u TKTU khác.
Di căn não và cột sống từ các ung thư khác thường gặp hơn rất nhiều so với ung thư TKTU nguyên phát. Có khoảng 15% bệnh nhân chết vì ung thư (80.000 người mỗi năm tại Hoa Kỳ) có triệu chứng di căn não, và có thêm 5% bệnh nhân có di căn cột sống. Do vậy, di căn não và cột sống đặt ra vấn đề lớn trong việc điều trị ung thư hệ toàn thân.
CÁC KHỐI U NÃO
TIẾP XÚC VỚI BỆNH NHÂN
Các đặc điểm lâm sàng
Các khối u não thường có một trong ba hội chứng: (1) tiến triển bán cấp của triệu chứng thần kinh khu trú; (2) cơn động kinh; hoặc (3) các rối loạn thần kinh không khu trú như đau đầu, mất trí nhớ, thay đổi tính cách hoặc thay đổi dáng đi. Các triệu chứng toàn thân như khó chịu, giảm cân, chán ăn, hay sốt thường gợi ý tới di căn nhiều hơn là các khối u nguyên phát.
Các triệu chứng thần kinh khu trú tiến triển là do chèn ép thần kinh và chất trắng do khối u xâm lấn và gây phù xung quanh. Ít gặp hơn, khối u não có biểu hiện giống như một cơn đột quỵ - một khởi phát của rối loạn thần kinh khu trú. Mặc dù biểu hiện này có thể do chảy máu trong khối u gây ra, nhưng thường không có xuất huyết và cơ chế vẫn chưa rõ. Các khối u thường gây xuất huyết bao gồm u thần kinh đệm cấp độ cao (high-grade), u hắc sắc tố di căn, và ung thư nhau (choriocarcinoma).
Động kinh có thể do phá vỡ tuần hoàn vỏ não. Các khối u xâm lấn và chèn ép vỏ não, thậm chí khối u màng não rất nhỏ, thì thường kèm theo cơn động kinh hơn so với khối ung thư dưới vỏ não. Các rối loạn chức năng thần kinh không khu trú thường là biểu hiện của tăng áp lực nội sọ, tràn dịch não, hoặc khối u lan tỏa. Khối u ở một số vùng của não có thể gây các rối loạn hành vi, ví dụ như khối u thùy trán có thể biểu hiện thay đổi tính cách, mất trí nhớ, hoặc trầm cảm.
Nhức đầu có thể do kích thích tại chỗ hoặc chiếm chỗ của cấu trúc nhạy cảm với đau hoặc do tăng toàn bộ trong tăng áp lực nội sọ. Đau đầu nặng mà không bớt khi nằm nghiêng là gợi ý của tổn thương khối choán chỗ. Đau đầu do tăng áp lực nội sọ thường đau toàn bộ đầu và đau từng cơn, xảy ra nhiều lần trong ngày. Đau đầu xảy ra nhanh trong vài phút, kéo dài khoảng 20-40 phút, và hết. Đau có thể làm bệnh nhân tỉnh dậy sau khi ngủ ngon khoảng 60-90 phút. Nôn có thể xảy ra khi có đau đầu nặng. Khi tăng áp lực nội sọ kéo dài thì đau đầu liên tục ở cường độ khác nhau. Tăng áp lực nội sọ cao có thể gây phù gai thị, mặc dù thường không có biều hiện ở trẻ sơ sinh hoặc người trên 55 tuổi.
Thang điểm Karnofsky rất hữu ích trong việc đánh giá bệnh nhân có khối u não. Điểm >= 70 thể hiện bệnh nhân có thể đi lại và tự chăm sóc được, thang điểm này thường được dùng để đánh giá chức năng nhằm điều trị tích cực.
Hình ảnh thần kinh
Chụp cắt lớp và chụp cộng hưởng từ có thể thấy có khối chiếm chỗ và tăng độ tương phản. Khối chiếm chỗ phản ánh thể tích mô khối u cũng như vùng phù nề xung quanh. Điển hình thì khối u não gây phù giãn mạch, với tích lũy nước dư thừa ở xung quanh chất trắng. Tăng độ tương phản biểu hiện hàng rào máu não bị phá vỡ trong khối u làm rò rỉ chất cản quang. U thần kinh đệm cấp độ thấp (low grade) thì không có tăng độ tương phản.
Chụp cắt lớp bức xạ Positron (PET) và chụp cắt lớp bằng bức xạ đơn photon (SPECT) có vai trò phụ trợ trong chẩn đoán hình ảnh của khối u não, chủ yếu trong phân biệt khối u tái phát từ mô hoại tử, có thể xảy ra sau khi chiếu xạ (xem bên dưới). Hình ảnh chức năng cùng với PET, MRI hoặc từ não đồ (magnetoencephalography) có thể có thể được sử dụng trong phẫu thuật hoặc phẫu thuật bằng tần số sóng radio để xác định ranh giới giải phẫu của khối u với các vùng não quan trọng như vùng vận động chính hay ngôn ngữ của vỏ não.
Xét nghiệm chẩn đoán
Các khối u não nguyên phát điển hình thì không gây bất thường về huyết thanh như tốc độ lắng máu tăng hoặc kháng nguyên đặc hiệu của khối u tăng. Trái lại, ung thư di căn vào hệ thống thần kinh, tùy thuộc vào loại u, mức độ lan rộng của u, có thể kèm theo các dấu hiệu ác tính toàn thân. Chọc dò dịch não tủy nói chung là không có giá trị trong chẩn đoán các khối u não, ngoại trừ di căn màng não mỏng; u bạch huyết nguyên phát TKTU, các khối u ngoại bì thần kinh nguyên thủy, bao gồm u nguyên bào tủy. Tác dụng cơ bản của chọc dò dịch não tủy trong đánh giá khối u não là để loại trừ chẩn đoán phân biệt khác, chẳng hạn bệnh nhiễm trùng hoặc bệnh mất myêlin. Hơn nữa, chọc dò dịch não tủy có thể làm tụt kẹt não xảy ra sớm hơn ở bệnh nhân có khối choán chỗ và chỉ nên thực hiện ở những bệnh nhân mà chẩn đoán hình ảnh thể hiện triệu chứng các bể nền phù hợp.
Điều trị các khối u não
ĐIỀU TRỊ TRIỆU CHỨNG
Glucocorticoid làm giảm phù xung quanh khối u não và cải thiện chức năng thần kinh; dexamethasone (liều ban đầu là 12-20 mg / ngày chia liều trong uống hoặc tiêm tĩnh mạch) được sử dụng bởi vì nó tương đối ít giữ muối. Bởi vì độc tính khi dùng glucocorticoid dài hạn, phải nhanh chóng giảm liều dexamethasone xuống đến thấp nhất mà có tác dụng làm giảm triệu chứng.
Điều trị động kinh xuất hiện cùng các khối u não cũng giống như điều trị các dạng động kinh cục bộ khác. Các thuốc đầu tiên bao gồm phenytoin, carbamazepin, và axit valproic có hiệu quả như nhau; leviractam và oxcarbazepine cũng sắp được sử dụng rộng rãi. Dùng thuốc chống động kinh nhằm mục đích phòng ngừa đối với tất cả các bệnh nhân có khối u não trên lều thường được áp dụng mặc dù không có bằng chứng nào chứng minh.
U thần kinh đệm và u bạch huyết thần kinh trung ương kèm theo nguy cơ cao huyết khối tĩnh mạch sâu và nghẽn mạch phổi, có thể là do các khối u tiết các yếu tố đông máu vào hệ tuần hoàn. Mặc dù xuất huyết trong khối u thần kinh đệm thường thấy trên mô bệnh học, nhưng bệnh nhân không có tăng nguy cơ chảy máu nội sọ do điều trị bằng thuốc chống đông. Nên dùng heparin liều thấp để dự phòng đối với các bệnh nhân u não không cử động được chi dưới, là các bệnh nhân có nguy cơ huyết khối tĩnh mạch sâu.
CÁC KHỐI U NÃO NGUYÊN PHÁT
Nguyên nhân
Tiếp xúc với bức xạ ion hoá là yếu tố nguy cơ do môi trường duy nhất được ghi nhận gây ra u thần kinh đệm. Một số hội chứng di truyền làm tăng nguy cơ mắc các khối u não (Bảng 374-1). Gen gây các khối u não, cũng như các bệnh ác tính khác, có hai loại, gen áp chế khối u và gen gây ung thư. Trong khi đột biến dòng tế bào mầm của những gen này xảy ra ở những bệnh nhân có hội chứng có khuynh hướng di truyền, hầu hết các khối u não không xảy ra ở những bệnh nhân có những hội chứng dễ nhận biết đó. Cũng giống trường hợp các loại u khác, đột biến soma luôn có mặt trong mô não ác tính. Nhân bản gen của thụ thể yếu tố tăng trưởng biểu bì (EGFR) xuất hiện trong khoảng một phần ba các trường hợp u nguyên bào thần kinh đệm đa hình (multiforme glioblastoma – GBM), là các u tế bào hình sao độ cấp độ cao nhất. Hơn nữa, phân tích di truyền học tế bào thường cho thấy sự thay đổi điển hình có thể là dấu hiệu của thay đổi trong nhiễm sắc thể của các gen liên quan đến ung thư. Trong các u tế bào hình sao (astrocytic tumors), ADN thường bị mất trên nhiễm sắc thể 10p, 17p, 13q, và 9. U tế bào thần kinh đệm ít gai (Oligodendrogliomas) thường bị xóa mã của 1p và 10q, do chuyển vị tâm động của nhiễm sắc thể và mất một trong các nhiễm sắc thể bị chuyển vị. Trong u màng não, phần nhiễm sắc thể 22q, chứa gen trong bệnh u xơ thần kinh, thường bị mất.
Bảng 374-1 Các Hội chứng Di truyền kèm theo u não:
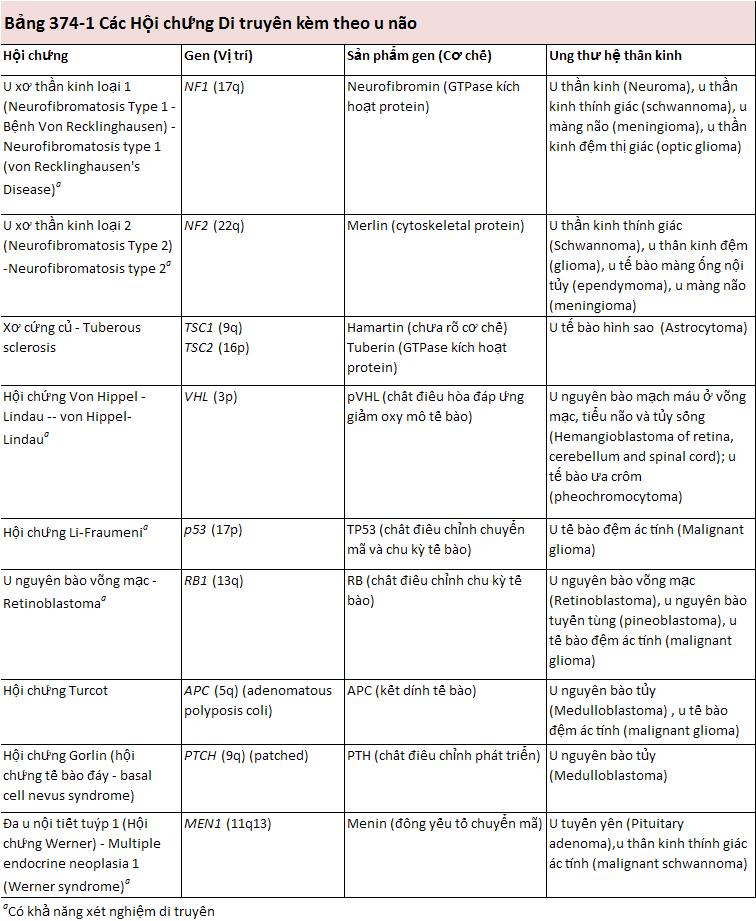
Hình sao của biến đổi gen di truyền thay đổi theo từng trường hợp u thần kinh đệm, ngay cả những u thần kinh đệm không biệt hóa trên mô học. Hơn nữa, u thần kinh đệm có tính di truyền không ổn định. Di truyền bất thường có xu hướng tích lũy theo thời gian, và những thay đổi này tương ứng với một kiểu hình ngày càng ác tính. Có ít nhất hai con đường di truyền dẫn đến sự phát triển của u nguyên bào thần kinh đệm đa hình – GBM (hình 374-1). Đường thứ nhất liên quan đến quá trình, thường trải qua nhiều năm, từ một u tế bào hình sao cấp độ thấp bằng việc xóa bỏ của nhiễm sắc thể 17 và bất hoạt của gen p53 dẫn đến một u thần kinh đệm cấp cao ác tính cùng với biến đổi nhiễm sắc thể kèm theo. Đường thứ hai được đặc trưng bởi sự xuất hiện đầu tiên của u thần kinh đệm ác tính cộng với nhân bản của gen EGFR và một gen p53 nguyên vẹn kèm theo các di truyền bất thường khác.
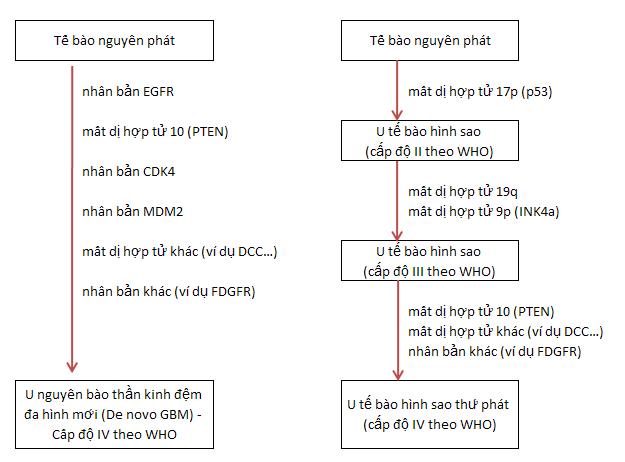
Mô hình bệnh sinh của u tế bào hình sao trên người. U nguyên bào thần kinh đệm đa hình – GBM điển hình thì không có các tổn thương báo hiệu trước, gọi là U nguyên bào thần kinh đệm đa hình mới (De novo GBM) thường kèm theo nhân bản của gen thụ thể tăng trưởng biểu bì (EGFR). U nguyên bào thần kinh đệm đa hình xảy ra kèm theo biến đổi gen lâu dài sau khi đã chẩn đoán u tế bào hình sao ở cấp độ thấp hơn thì ít gặp hơn. Những u này được gọi là U tế bào hình sao thứ phát. Biến đổi thường gặp nhất là đột biến gen p53 và INK4a. Các gen khác liên quan đến sự phát triển một u não nguyên phát bao gồm CDK4, MDM2, DDC, and PDGFR.
U tế bào hình sao (astrocytoma)
Các khối u có hình sao đặc trưng trên mô học là ung thư nguyên phát nội sọ phổ biến nhất. (Hình 374-2). Hệ thống phân loại mô học được sử dụng rộng rãi nhất là hệ thống bốn cấp độ của Tổ chức Y tế Thế giới (WHO). Cấp độ I là các thay đổi mô học đặc biệt của u tế bào hình sao xảy ra chủ yếu ở trẻ em và có tiên lượng rất tốt sau phẫu thuật cắt bỏ. Nó bao gồm u sao bào lông ở trẻ vị thành niên (juvenile pilocytic astrocytoma), u tế bào hình sao tế bào khổng lồ dưới màng nội tủy – subependymal giant cell astrocytoma (xảy ra hầu hết ở các bệnh nhân u xơ củ – tuberous sclerosis), và u sao bào vàng đa hình (pleiomorphic xanthoastrocytoma). Đối lập với u nguyên bào thần kinh đệm đa hình (GBM) cấp độ IV, là u đang tiến triển trên lâm sàng. U tế bào hình sao (cấp độ II) và u tế bào hình sao mất biệt hóa (cấp độ III) là trung gian giữa các biểu hiện lâm sàng và mô học. Các đặc tính mô học trong cấp độ cao hơn bao gồm tăng sinh tế bào, bất thường nhân và tế bào chất, tăng sản nội mô, hoạt động nguyên phân, và hoại tử. Tăng sản nội mô và hoại tử là các yếu tố tiên đoán có giá trị cao đối với u đang tiến triển.
Hình 374-2:
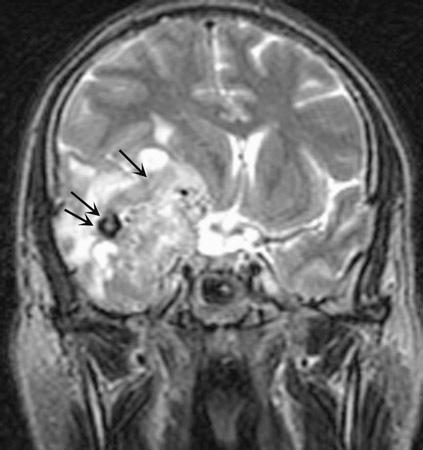
U tế bào hình sao ác tính (u nguyên bào đệm - glioblastoma). Hình ảnh tập trung đậm proton tại khớp trán đỉnh trên chụp cộng hưởng từ thùy thái dương biểu hiện một khối u thùy thái dương phải không đồng nhất (mũi tên) chèn ép các não thất bên và não thất ba. Những vùng có tín hiệu giảm – hypointense (mũi tên kép) biểu hiện hoặc bị chảy máu hoặc vôi hóa. Dấu hiệu cường độ tín hiệu cộng hưởng từ không đồng nhất là đặc trưng của u nguyên bào đệm (glioblastoma).
Định lượng hoạt động nguyên phân tương ứng với tiên lượng bệnh. Chỉ số tăng sản có thể xác định bằng nhuộm hóa chất miễn dịch tế bào bằng các kháng thể của kháng nguyên nhân tế bào tăng sản hoặc bằng kháng thể đơn dòng tên là Ki-67 cho kết quả là sự có mặt của proteine histone trong các tế bào tăng sản nhưng không có mặt trong các tế bào không hoạt động.
Tiên lượng bệnh nhân u não liên quan chặt chẽ với các cấp độ mô học của khối u. Trong một nhóm đại diện dân Phần Lan, thời gian sống trung bình là 93,5 tháng đối với u tế bào hình sao cấp độ I hoặc II, 12,4 tháng đối với bệnh nhân cấp độ III (u tế bào hình sao mất biệt hóa – anaplastic astrocytoma), và 5,1 tháng đối với bệnh nhân có khối u cấp độ IV (u nguyên bào thần kinh đệm đa hình – GBM). Mặc dù tỷ lệ sống nói chung là thấp hơn so với báo cáo, nhưng báo cáo chọn nhóm đại diện dựa trên kinh nghiệm và không bị ảnh hưởng bởi lựa chọn thiên vị. Tiên lượng xấu trên lâm sàng ở bệnh nhân trên 65 tuổi và có chức năng kém dựa theo thang điểm Karnofsky.
U TẾ BÀO SAO CẤP ĐỘ THẤP
U tế bào sao cấp độ thấp phổ biến ở trẻ em hơn là người lớn. U sao bào lông – Pilocytic astrocytoma, đặt tên theo đặc tính tế bào hình thoi, là u não phổ biến ở trẻ em và thường là lành tính. Nó thường xảy ra ở tiểu não và có ranh giới rõ với não liền kề. Phẫu thuật cắt bỏ hoàn toàn cho phép bệnh nhân sống khỏi bệnh lâu dài.
Nói chung thời gian sống trung bình u tế bào sao cấp độ II là 5-6 năm. Chưa rõ thời điểm tối ưu để phẫu thuật và xạ trị. Khi mà u tế bào sao đã xâm nhập quanh não thì phẫu thuật cắt bỏ hoàn toàn là không thể. Hơn nữa, u có tính di truyền không ổn định, và tích lũy đột biến theo thời gian, làm u càng tiến triển mạnh. Đối với các bệnh nhân có triệu chứng choán chỗ hoặc động kinh khó kiểm soát, phẫu thuật cắt bỏ có thể làm giảm triệu chứng. Đối với bệnh nhân không có triệu chứng hoặc rất ít triệu chứng, nên làm sinh thiết chẩn đoán, và khi có thể phẫu thuật được, thì nên cắt bỏ khối u. Cho dù xạ trị ngay sau phẫu thuật hay tại thời điểm u tiến triển thì nói chun đều không ảnh hưởng đến thời gian sống, nhưng xạ trị ngay làm chậm tiến triển của khối u. Không xác định được vai trò của hóa trị liệu trong điều trị u tế bào sao cấp độ thấp.
U TẾ BÀO SAO CẤP ĐỘ CAO
Phần lớn các các u tế bào sao phát hiện ở người lớn ở cấp độ cao, trên lều, và không có ranh giới xác định rõ ràng giữa mô bình thường và mô ác tính. Các tế bào khối u di chuyển ra khỏi u chính và xâm nhập vào não liền kề, thường đi theo các đường chất trắng. Các chẩn đoán hình ảnh không chỉ ra phạm vi đầy đủ của khối u. Hầu như các khối u này cuối cùng đều tử vong. Thời gian sống trung bình của bệnh nhân u tế bào sao cấp độ III là dưới 3 năm và khối u cấp độ IV là dưới 1 năm. Thời gian sống lâu hơn trên bệnh nhân trẻ tuổi, tình trạng bệnh tốt, và phẫu thuật cắt bỏ rộng hơn. Giai đoạn cuối của u tế bào sao, đặc biệt ở khối u tại hố sau, có thể di căn theo dịch não tủy (CSF) đến cột sống. Rất hiếm di căn ngoài thần kinh trung ương.
U tế bào sao được điều trị bằng Gluco corticoid, phẫu thuật, xạ trị và hóa trị. Dexamethason thường được dùng tại thời điểm chẩn đoán và tiếp tục dùng trong suốt thời gian xạ trị. Sau khi xạ trị kết thúc, giảm liều dexamethasone đến thấp nhất có thể.
Vì u tế bào sao xâm nhập vào não bình thường vùng lân cận, do đó phẫu thuật cắt bỏ toàn bộ là không thể. Tuy vậy, các nghiên cứu hồi cứu cho thấy phạm vi cắt bỏ khối u tương quan với thời gian sống ở các bệnh nhân trẻ. Vì vậy, các khối u có thể tiếp cận được thì thường được phẫu thuật triệt để. Phẫu thuật được chỉ định để lấy mô làm chẩn đoán tế bào hoặc để kiểm soát choán chỗ.
Xạ trị sau phẫu thuật kéo dài thời gian sống và cải thiện chất lượng sống. Nếu điều trị đơn thuần bằng dexamethasone sau phẫu thuật, thời gian sống trung bình của bệnh nhân u nguyên bào đệm (glioblastoma) dưới 65 tuổi là 7-9 tháng. Với xạ trị, thời gian sống kéo dài tới 11-13 tháng. Đối với các khối u tế bào đệm nguyên phát, xạ trị được dùng đối với khối u choán chỗ, được xác định bằng tăng độ tương phản trên chụp cắt lớp (CT) hoặc chụp cộng hưởng từ (MRI), cộng thêm 2cm rìa ranh giới. Tổng liều xạ trị là 5000-7000 cGy chia 25-35 liều bằng nhau, điều trị 5 ngày mỗi tuần.
Vai trò của phẫu thuật xạ trị định vị ba chiều (stereotaxic radiosurgery) và liệu pháp chiếu xạ áp sát gắn phóng xạ (interstitial brachytherapy) trong điều trị u thần kinh đệm không chắc chắn. Phẫu thuật xạ trị định vị ba chiều là dùng một liều bức xạ cao tập trung bắn vào vùng mô đã được định vị chính xác bằng một liều điều trị duy nhất. Phẫu thuật xạ trị định vị ba chiều có thể hủy diệt khối u trong vùng chiếu xạ. Một hạn chế của phẫu thuật xạ trị định vị ba chiều là nó chỉ có thể được sử dụng để điều trị các khối u tương đối nhỏ, có đường kính tối đa 4cm. Liệu pháp chiếu xạ áp sát gắn phóng xạ, gắn chất phóng xạ vào khối u, nói chung được dùng để điều trị các khối u tái phát vì gây độc và hoại tử các mô não lân cận.
Hóa trị có hiệu quả hạn chế và thường được sử dụng như là một liệu pháp bổ xung sau phẫu thuật và xạ trị. Temozolomide, một tác nhân alkyl dùng đường uống, đã thay thế Nitrosurea, gồm carmustine (BCNU) và lomustine (CCNU), như là thuốc hóa trị sử dụng rộng rãi nhất trong u thần kinh đệm cấp độ cao. Nói chung, temozolomide dung nạp tốt hơn so với nitrosourea, đặc biệt là ít gây mệt mỏi và ít gây độc cho phổi hơn, và có lợi thế là dùng đường uống. Hơn nữa, một thử nghiệm ngẫu nhiên dùng temozolomide như là điều trị bổ xung cho xạ trị trong u nguyên bào thần kinh đệm đa hình (GBM) cho kết quả tốt hơn so với xạ trị đơn thuần. Các bệnh nhân kết hợp xạ trị và temozolomide có thời gian sống trung bình dài hơn 2,5 tháng so với bệnh nhân xạ trị đơn thuần. Thời gian sống dường như bị hạn chế ở nhóm bệnh nhân bị methyl hóa và bất hoạt khởi động gen MGMT mã hóa O6-methylguanine-DNA methyltransferase.
Một phương pháp hóa trị u thần kinh đệm cấp độ cao khác có kết quả đối với thời gian sống trong các thử nghiệm là phẫu thuật cấy tấm polyme vào chỗ u đã cắt bỏ để giải phóng BCNU tại chỗ vào vùng não xung quanh. Hiệu quả của phương pháp này tương tự và có lẽ ít hiệu quả hơn so với dùng temozolomide, mặc dù không gây độc hóa trị toàn thân.
Các thử nghiệm hóa trị u não nhằm vượt qua hàng rào máu não bằng cách tiêm thuốc hóa trị vào khối u hoặc tiêm vào trong động mạch sau khi làm gián đoạn hàng rào máu não. Các liệu pháp nhắm vào từng phân tử (molecularly targeted therapies) cũng đang được thử nghiệm ở bệnh nhân u nguyên bào thần kinh đệm đa hình (GBM). Đặc biệt khi mà đột biến và quá biểu hiện của thụ thể yếu tố tăng trưởng biểu bì (EGFR) phổ biến trong u nguyên bào thần kinh đệm đa hình (GBM), chất đối kháng hoặc ức chế đường truyền tín hiệu của thụ thể yếu tố tăng trưởng biểu bì (EGFR) đang được đánh giá trên bệnh nhân u nguyên bào thần kinh đệm đa hình (GBM) trong các thử nghiệm lâm sàng.
Tăng sinh thần kinh đệm toàn bộ não (Gliomatosis cerebri) là một dạng u tế bào sao hiếm gặp, trong đó các tế bào sao ác tính xâm nhập lan tỏa trong não và không có khối u khu trú. Nó biểu hiện một hội chứng rối loạn thần kinh trung ương nhiều ổ hoặc một rối loạn chung bao gồm mất trí nhớ, thay đổi tính cách hoặc động kinh. Chẩn đoán hình ảnh thường không đặc hiệu, và cần sinh thiết để chẩn đoán. Tăng sinh thần kinh đệm toàn bộ não được điều trị bằng xạ trị toàn bộ não hoặc temozolomide; ở các bệnh nhân được lựa chọn, xạ trị toàn bộ trục não tủy.
U tế bào thần kinh đệm ít gai (Oligodendrogliomas)
U tế bào thần kinh đệm ít gai (Oligodendrogliomas), chiếm 15% trong tổng số u thần kinh đệm ở người lớn, tiến triển lành tính hơn và đáp ứng tốt hơn với điều trị độc tế bào so với u tế bào hình sao (astrocytomas). Thời gian sống trung bình là 7-8 năm ở u tế bào thần kinh đệm ít gai cấp độ II, và có một số lượng đáng kể bệnh nhân sống rất lâu (> 10 năm). Đối với u tế bào thần kinh đệm ít gai cấp độ III hoặc u tế bào thần kinh đệm ít gai mất biệt hóa (anaplastic oligodendroglioma), thời gian sống trung bình khoảng 5 năm. U tế bào thần kinh đệm ít gai hầu hết ở vị trí trên lều, ở người lớn, và khoảng 30% có vùng vôi hóa (Hình 374-3).
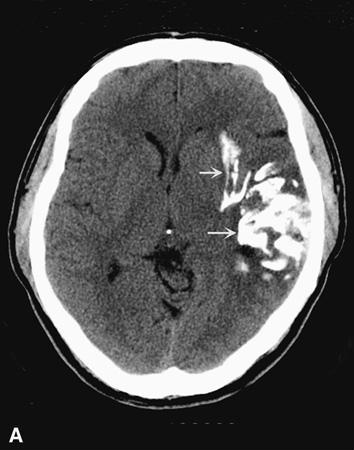
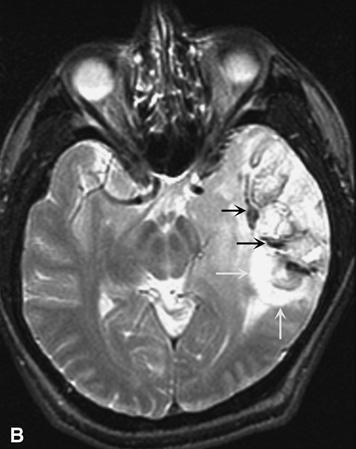
U tế bào thần kinh đệm ít gai (Oligodendrogliomas). A. Chụp cắt lớp không cản quang cho thấy khối vôi hóa ở thùy thái dương trái (mũi tên) kèm theo hiệu ứng khối u nhẹ có ít phù nề. B. Hình ảnh chụp cộng hưởng từ T2 thể hiện một khối không đồng nhất kèm theo dấu hiệu giảm tín hiệu – hypointense (các mũi tên đen) bao bọc bởi một vùng tín hiệu tăng đậm (các mũi tên trắng), phù hợp với một khối u thùy thái dương phải vôi hóa. Khối u xâm lấn vào vùng thùy thái dương giữa bên trái và chèn ép não giữa.
Theo quy luật, u tế bào thần kinh đệm ít gai ít thâm nhiễm hơn u tế bào hình sao, do đó phẫu thuật cắt bỏ triệt để hơn. Các đặc điểm về mô học như phân bào, hoại tử và bất thường nhân thường xuất hiện trong giai đoạn tiến triển lâm sàng. Nếu các đặc điểm này nổi trội, khối u được gọi là u tế bào thần kinh đệm ít gai mất biệt hóa (anaplastic oligodendroglioma). Một số u thần kinh đệm chứa các tế bào hỗn hợp có cả đặc điểm của u tế bào hình sao và u tế bào thần kinh đệm ít gai. Nếu đặc điểm mô học này nổi trội, u được gọi là u thần kinh đệm hỗn hợp (mixed glioma hoặc oligoastrocytoma). Càng nhiều đặc điểm tế bào thần kinh đệm ít gai thì giai đoạn lâm sàng càng lành tính.
Cần chẩn đoán bằng phẫu thuật sinh thiết định vị ba chiều (stereotaxic biopsy). Rất nhiều u tế bào thần kinh đệm ít gai đáp ứng tốt với phẫu thuật cắt bỏ triệt để. Ngoài ra, u tế bào thần kinh đệm ít gai có thể đáp ứng rất tốt với hóa trị liệu kết hợp toàn thân với procarbazine, lomustine, và vincristine (PCV), hoặc với temozolomide, mặc dù chỉ định temozolomide không được Cục Quản lý Dược phẩm và Thực phẩm Hoa Kỳ (FDA) phê chuẩn, hiện nay nó được sử dụng rộng rãi hơn PCV. U tế bào thần kinh đệm ít gai có xóa mã nhiễm sắc thể 1p luôn luôn đáp ứng với hóa trị, nhưng chỉ có khoảng 25% u tế bào thần kinh đệm ít gai không có xóa mã nhiễm sắc thể 1p có đáp ứng với hóa trị. Việc xóa mã đồng thời 1p và 19q do chuyển đoạn tâm động của các nhiễm sắc thể 1 và 19, dự đoán đáp ứng hóa trị lâu dài (trung bình >30 tháng) và thời gian sống lâu hơn. Có vẻ như là chuyển đoạn nhiễm sắc thể định nên một thể bệnh u tế bào thần kinh đệm ít gai mất biệt hóa (anaplastic oligodendroglioma) có giai đoạn tự nhiên ít trầm trọng hơn, và đáp ứng hóa trị là một dấu hiệu khác của kiểu hình thuận lợi.
U tế bào màng ống nội tủy (Ependymomas)
Ở người lớn, loại mô học thường gặp nhất là u tế bào màng ống nội tủy dạng nhú nhày, thường phát sinh từ dây cùng của ống tủy sống và xuất hiện ở vùng thắt lưng – cùng. Thuật ngữ nhú-nhày dùng để chỉ sự sắp xếp hình nhú của tế bào ung thư, trong đó chúng sản xuất ra chất nhày. U tế bào màng ống nội tủy ở người lớn cũng có thể xảy ra trong não hoặc ở vị trí cao hơn ở tủy sống. Trên chụp cắt lớp (CT) hoặc cộng hưởng từ (MRI), u tế bào màng ống nội tủy thể điển hình biểu hiện các khối lan tỏa ranh giới tương đối rõ với mô thần kinh liền kế cận. Sau cắt bỏ toàn bộ, tiên lượng bệnh tốt, với tỷ lệ >80% sống khỏe mạnh thêm 5 năm. U tế bào màng ống nội tủy không cắt bỏ toàn bộ được thì điều trị bằng xạ phẫu định vị ba chiều (stereotaxic radiosurgery) hoặc cùng với một đợt xạ trị chiếu tia từ bên ngoài.
U nguyên bào tủy (Medulloblastomas) và U ngoại bì thần kinh nguyên thủy (Primitive Neuroectodermal Tumors - PNET)
Những khối u này tế bào rất ác tính được cho là phát sinh từ các tế bào thần kinh nguyên thủy (precursor cells). U nguyên bào tủy xuất hiện ở hố sau, và cùng với u tế bào hình sao (astrocytomas) là những u não ác tính thường gặp nhất ở trẻ em. PNET là thuật ngữ dùng cho các khối u không thể phân biệt về mặt mô học với u nguyên bào tủy nhưng xảy ra ở người lớn hoặc xảy ra tại vị trí trên lều ở trẻ em. Ở người lớn, >50% hiện diện tại hố sau. Các khối u thường lan theo đường dịch não tủy (cerebralspinal fluid -CSF).
Nên phẫu thuật cắt bỏ triệt để nếu có thể, càng để lại ít khối u, tiên lượng càng tốt. Ở người lớn, sau phẫu thuật cắt bỏ PNET, nên chiếu xạ toàn bộ trục não tủy, tập trung liều cao tại vị trí u nguyên phát. Nếu khối u không có biểu hiện lan rộng thì tiên lượng tốt. Điều trị tích cực có thể kéo dài thời gian sống, mặc dù một nửa số bệnh nhân tái phát trong vòng 5 năm. Trong khi hóa trị được sử dụng rộng rãi trong điều trị U nguyên bào tủy và U ngoại bì thần kinh nguyên thủy ở trẻ em, thì chưa xác định được vai trò của nó trong điều trị ở người lớn.
U lymphô hệ thần kinh trung ương (CNS Lymphoma)
U LYMPHÔ HỆ THẦN KINH NGUYÊN PHÁT (PRIMARY CNS LYMPHOMA)
U lymphô hệ thần kinh trung ương nguyên phát thể điển hình là tế bào B ác tính cấp độ cao hiện diện trong trục não tủy mà không có bằng chứng u lymphô hệ thống. Các u này thường xảy ra trên các bệnh nhân suy giảm miễn dịch (immunocompromised), đặc biệt trên bệnh nhân ghép tạng và bệnh nhân mắc hội chứng suy giảm miễn dịch mắc phải (AIDS). U lymphô hệ thần kinh trung ương nguyên phát luôn luôn kèm theo nhiễm vi-rút Epstein-Barr của các tế bào khối u.
Trên các bệnh nhân có đáp ứng miễn dịch, các nghiên cứu hình ảnh thần kinh cho thấy tổn thương luôn tăng cường khối lượng (enhancing mass lesion). Có thể dùng sinh thiết định vị ba chiều (stereotaxic needle biopsy) để chẩn đoán. Phẫu thuật cắt bỏ không có lợi trừ khi phải làm để giảm áp lực ngay lập tức do đe dọa tính mạng. Tổn thương màng não mềm xuất hiện khoảng 15% bệnh nhân thời gian đầu và 50% xuất hiện trong thời gian bệnh. Hơn nữa, tới 15% bệnh nhân bệnh lan tới mắt. Vì thế, khám mắt bằng đèn có khe (slit lamp), nếu được chỉ định, thì cần chọc hút tiền phòng hoặc sinh thiết dịch kính để xác định cổng chiếu xạ.
U lymphô hệ thần kinh trung ương nguyên phát tiên lượng xấu hơn so với u lymphô có cấu trúc mô học tương tự xảy ra ngoài hệ thần kinh trung uơng. Nhiều bệnh nhân đáp ứng lâm sàng và quang tuyến nhanh đối với Glucocorticoid, tuy nhiên, hầu như tái phát sau vài tuần. Hóa trị là điều trị chính. Một liều duy nhất rituximab truớc khi hóa trị độc tế bào chừng nào còn tồn tại một khối đậm thiếu hàng rào máu não. Hóa trị liều cao methotrexate, nhưng đa hóa trị liệu, thường dùng vincristine và procarbazine kèm theo, dường như có hiệu quả hơn khi dùng một mình methotrexate. Ở bệnh nhân dưới 60 tuổi thì tiếp tục điều trị bằng xạ trị toàn bộ não (whole-brain radiation therapy - WBRT). Ở bệnh nhân trên 60 tuổi thì trì hoãn xạ trị toàn bộ não càng lâu càng tốt hoặc dùng giảm liều vì nguy cơ mất trí nhớ, rối loạn dáng đi, tiểu són là các biểu hiện muộn của nhiễm độc bức xạ. Điều trị củng cố điển hình thường dùng cytarabine liều cao. Hóa trị liệu bằng đường động mạch có kèm theo hoặc không kèm theo phá vỡ hàng rào máu não là một điều trị thay thế. Có thể thêm hóa trị liệu khoang ngoài màng cứng với methotrexate nếu có tổn thương màng não mềm, nhưng chưa có bằng chứng nào cho thấy có thêm lợi ích nếu sử dụng methotrexate liều cao. Mặc dù điều trị tích cực, trên 90% bệnh nhân có tái phát bệnh thần kinh trung ương. Tỷ lệ sống trung bình của bệnh nhân có đáp ứng tốt với điều trị methotrexate liều cao là trên 3 năm.
Trên bệnh nhân suy giảm miễn dịch, U lymphô hệ thần kinh trung ương nguyên phát thường biểu hiện tập trung hình tròn hơn là phân tán ở trên hình ảnh chụp cắt lớp hoặc cộng hưởng từ (Hình 374-4). Do đó, không thể dùng hình ảnh để phân biệt U lymphô hệ thần kinh trung ương nguyên phát hay do di căn ung thư hay do nhiễm khuẩn, đặc biệt là bệnh nhiễm ký sinh trùng toxoplasmosis. Cách xử lý trường hợp tiến thoái lưỡng nam này trên một bệnh nhân có tình trạng thần kinh ổn định là cho dùng kháng sinh điều trị toxoplasmosis trong vòng 2-3 tuần, sau đó làm chẩn đoán hình ảnh lại. Nếu hình ảnh có cải thiện rõ ràng, điều trị kháng sinh được tiếp tục. Nếu không, làm sinh thiết não định vị ba chiều, trong đó có nhiều rủi ro đáng kể ở bệnh nhân suy giảm miễn dịch hơn là bệnh nhân miễn dịch tốt. Ngoài ra, khi tình trạng lâm sàng cho phép chọc tủy sống an toàn, xét nghiệm dịch não tủy thấy có ADN của vi rút Epstein-Barr trong dịch não tủy cộng với chẩn đoán hình ảnh có dấu hiệu u lymphô cho phép chẩn đoán U lymphô hệ thần kinh trung ương nguyên phát. Ở người nhận tạng ghép, việc đảo ngược tình trạng ức chế miễn dịch có thể cải thiện kết quả điều trị. Tỷ lệ sống ở U lymphô hệ thần kinh trung ương nguyên phát có hội chứng suy giảm miễn dịch mắc phải (AIDS) là rất thấp, nói chung là dưới hoặc đến 3 tháng; tình trạng truớc điều trị, mức độ ức chế miễn dịch, mức độ phát tán trong hệ thần kinh trung ương khi chẩn đoán tất cả đều ảnh hưởng đến kết quả điều trị.
Hình 374-4:
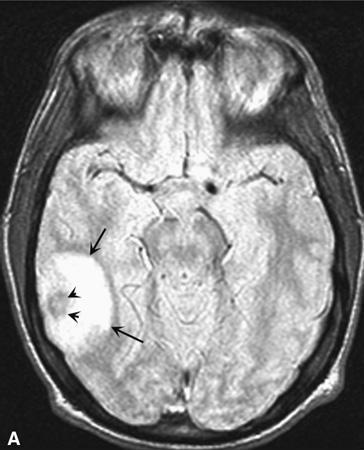
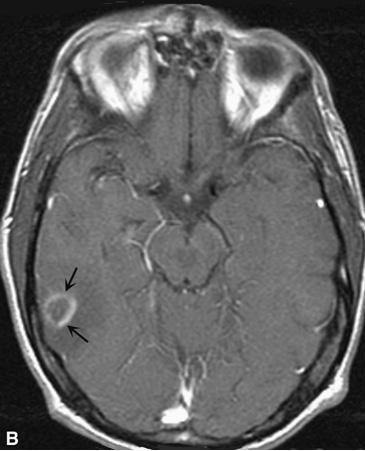
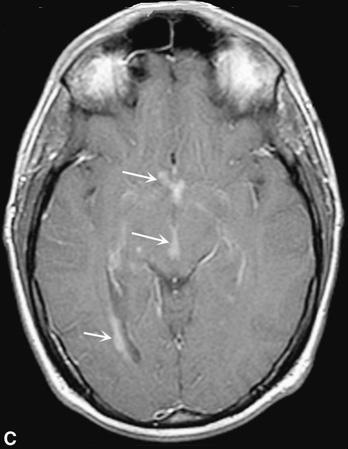
U lymphô hệ thần kinh trung ương (CNS Lymphoma). A. Hình ảnh tập trung đậm proton tại trên chụp cộng hưởng từ thùy thái dương biểu hiện một nhân có tín hiệu yếu (mũi tên nhỏ) bao quanh bởi một vòng phù nề có tín hiệu cao hơn (các mũi tên lớn hơn). B. Chụp cản quang hướng trục cộng hưởng từ T1 biểu hiện một vòng đậm bao quang bởi một vòng phù nề không cản quang. Trên bệnh nhân AIDS này, tổn thương đơn độc này phù hợp với hoặc là u lym-phô (lymphoma) hoặc là bệnh nhiễm ký sinh trùng toxoplasmosis. Nghiêng về bệnh nhiễm ký sinh trùng toxoplasmosis khi có nhiều tổn thương. C. Trên một bệnh nhân khác có viêm màng não bệnh bạch cầu (lymphomatous meningitis), chụp cản quang hướng trục cộng hưởng từ sau T1 tại não giữa biểu hiện nhiều vùng cản quang bất thường quanh não thất và dưới màng não thất (các mũi tên). U lym-phô có xu hướng lan ra dưới màng não thất tại vùng tiếp xúc giữa dịch não tủy và nhu mô não.
U LYMPHÔ HỆ THẦN KINH THỨ PHÁT (SECONDARY CNS LYMPHOMA)
U lymphô hệ thần kinh trung ương thứ phát là một biểu hiện của bệnh hệ thống và hầu như luôn luôn xảy ra ở người lớn u lymphô tế bào B tiến triển hay bệnh bạch cầu tế bào B có sự tham gia của các khối u xương, tủy xương, tinh hoàn, hoặc các xoang sọ. Màng não mềm là vị trí di căn thần kinh trung ương phổ biến nhất. U lymphô màng não mềm thường có thể chẩn đoán bằng chụp cắt lớp có cản quang hoặc chụp cộng hưởng từ với gadolinium não và tủy sống hoặc bằng xét nghiệm dịch não tủy. Điều trị bao gồm điều trị toàn thân, hóa trị liệu khoang ngoài màng cứng, và xạ trị thần kinh trung ương. Thuờng thì làm giảm bệnh màng não mềm có hiệu quả, mặc dù tiên lượng chung dựa trên giai đoạn của u lymphô. Di căn u lymphô trong não có thể điều trị bằng xạ trị hoặc hóa trị toàn thân.
U màng não (Meningiomas)
U màng não có nguồn gốc từ trung phôi bì, có thể là từ các tế bào phát triển đến các nút nhện. Những khối u này thường lành tính và gắn vào màng cứng (Dura). Chúng có thể xâm nhập vào hộp sọ nhưng chỉ thường xuyên xâm nhập não bộ. U màng não thường xảy ra dọc theo xoang tĩnh mạch đứng dọc giữa, trên nếp não, trong góc tiểu não-cầu não, và dọc theo lưng ty sống. Thường xảy ra ở phụ nữ nhịều hơn nam giới, tỷ lệ cao ở tuổi trung niên.
U màng não có thể vô tình phát hiện trên chụp cắt lớp hay cộng hưởng từ, hoặc có thể biểu hiện động kinh cục bộ, suy giảm thần kinh tiến triển chậm hoặc triệu chứng tăng áp lực nội sọ (ICP). Hình ảnh quang tuyến một khối đậm ở màng cứng ngoài trục cản quang đồng nhất là dấu hiệu chẩn đoán cơ bản, mặc dù cũng phải xem xét có phải di căn màng cứng hay không (Hình 374-5). U màng não có thể có dấu hiệu “đuôi màng cứng” (dural tail), một vạch cản quang màng cứng nằm dọc theo khối u chính, tuy nhiên, dấu hiệu này có gặp trong các u màng cứng khác.
Hình 374-5:
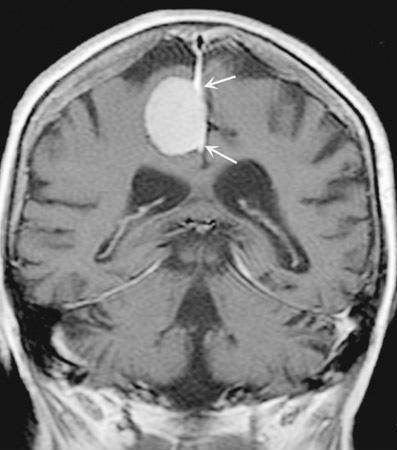
U màng não (Meningiomas). Hình ảnh chụp cộng hưởng từ cản quang khớp trán đỉnh sau T1 biểu hiện khối cản quang ngoài trục xuất phát từ liềm não (mũi tên). Có dấu hiệu “đuôi màng cứng” (dural tail) cản quang đậm ở vị trí trên dọc theo vách bán cầu.
Chữa khỏi u màng não bằng phẫu thuật cắt bỏ toàn bộ u màng não lành tính. Nếu cắt bỏ toàn bộ không có kết quả thì xạ trị chiếu tia từ bên ngoài hoặc bằng xạ phẫu định vị ba chiều (stereotaxic radiosurgery) làm giảm tỷ lệ tái phát xuống dưới 10%. Đối với u màng não không thể phẫu thuật thì xạ phẫu là lựa chọn điều trị. U màng não không có triệu chứng tình cờ phát hiện ở người già có thể theo dõi một cách an toàn bằng quang tuyến; những khối u này phát triển với tỷ lệ vài milimét đường kính mỗi năm và hiếm khi có triệu chứng.
U màng não hiếm khi xâm lấn não hoặc có bằng chứng ác tính về mô học chẳng hạn như có sự đa dạng về nhân (nuclear pleomorphism) và bất thường tế bào. Chỉ số gián phân cao cũng là yếu tố tiên đoán u đang tiến triển. U tế bào quanh mao mạch (hemangiopericytoma), mặc dù không thực sự là một u màng não, là một khối u màng não đang tiến triển đặc biệt. U màng não với đặc tính tiến triển và u tế bào quanh mao mạch thường tái phát, thậm chí đã cắt bỏ toàn bộ sau khám toàn diện và nên xạ trị sau phẫu thuật. Hóa trị tỏ ra không có hiệu quả.
U bao sợi thần kinh (Schwannomas)
Các khối u này còn gọi là u thần kinh (neuromas, neurinomas hoặc neurolemmomas). Nó bắt nguồn từ các tế bào Schwann của rễ thần kinh, hầu hết gặp ở thần kinh sọ não số 8 (U thần kinh tiền đình – vestibular schwannoma, còn gọi là u thần kinh thính giác – acoustic schwannoma hoặc acoustic neuroma). Dây thần kinh sọ não số 5 gặp phổ biến thứ hai; tuy nhiên, u bao sợi thần kinh có thể phát triển từ bất cứ dây thần kinh sọ hoặc tủy sống trừ dây thần kinh thị giác và khứu giác, dây thần kinh mà có bao myelin từ các tế bào thần kinh đệm ít gai (oligodendroglia) hơn là tế bào Schwann. U xơ thần kinh (Neurofibromatosis - NF) loại 2 (xem bên dưới) dẫn đến u thần kinh thính giác. U bao sợi thần kinh của rể thần kinh tủy sống cũng xảy ra ở các bệnh nhân U xơ thần kinh loại 2 cũng như U xơ thần kinh loại 1.
U bao sợi thần kinh sọ não số 8 điển hình bắt nguồn từ nhánh của dây thần kinh tiền đình. Trên chụp cộng hưởng từ, chúng là khối ung thư cản quang đậm đồng nhất (Hình 374-6). U thần kinh tiền đình làm rộng ống tai trong, đây là đặc điểm chẩn đoán hình ảnh để phân biệt với các khối u góc tiểu não – cầu não. Bởi vì hệ tiền đình thích nghi dần với tổn thương dây thần sinh sọ não số 8, bệnh nhân u thần kinh tiền đình điển hình có biểu hiện mất thính lực một bên hơn là chóng mặt hoặc các triệu chứng tiền đình khác. Mất thính lực một bên không rõ nguyên nhân nên đo thính lực và chụp cộng hưởng từ. U thần kinh tiền đình phát triển có thể chèn ép tiểu não, cầu não hoặc dây thần kinh mặt. U bao sợi thần kinh lành tính về mặt mô học và lâm sàng và rất ít trường hợp ngoại lệ.
Hình 374-6:
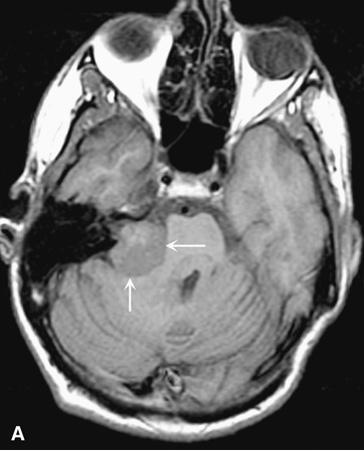
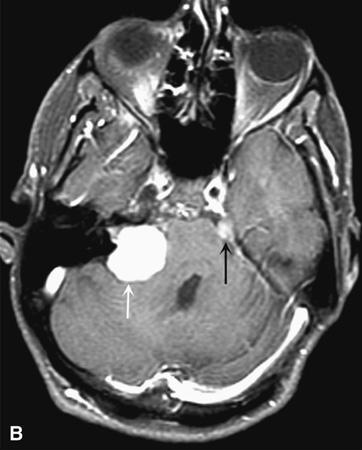
U thần kinh tiền đình (vestibular schwannoma). A. Chụp cộng hưởng từ hướng trục không cản quang góc tiểu não-cầu não biểu hiện khối ngoài trục xâm lấn vào ống tai trong bị giãn rộng, thay thế cầu não (mũi tên). B. Chụp cản quang sau T1 biểu hiện tập cường độ trung đậm trong u thần kinh tiền đình (mũi tên trắng). Cản quang bất thường của dây thần kinh số 5 (mũi tên đen) rất có thể là biểu hiện của một u bao sợi thần kinh khác trên bệnh nhân có u xơ thần kinh loại 2 (Neurofibromatosis Type 2) này.
Nên phẫu thuật cắt bỏ u bao sợi thần kinh nếu có thể. Khi khối u nhỏ, có thể bảo tồn thính lực của tai liên quan. Trong trường hợp khối u lớn, bệnh nhân thường bị điếc; tuy nhiên, phẫu thuật được chỉ định để giảm chèn ép thêm các cấu trúc hố sau. Xạ phẫu định vị ba chiều (stereotaxic radiosurgery) điều trị u bao sợi thần kinh cũng hiệu quả và tỷ lệ biến chứng tương đương với phẫu thuật.
Các u não lành tính khác
Các khối u dạng biểu bì (Epidermoid tumors) là các khối u nang với các tế bào biểu bì tăng sinh ở ngoại vi và nhiều tế bào trưởng thành hướng về trung tâm của nang. Những tế bào trưởng thành bong vào trong dịch giữa nang. Các khối u dạng biểu bì được cho là phát sinh từ phôi biểu bì còn lại trong sọ. Khối u xuất hiện ngoài trục gần đường giữa, trong hố sọ giữa, vùng tuyến yên hoặc góc tiểu não – cầu não. Các tổn thương này có ranh giới rõ và dễ dàng phẫu thuật cắt bỏ hoàn toàn. Không cần thiết xạ trị sau phẫu thuật.
Các u nang dạng bì (Dermoid cysts) được cho rằng phát sinh từ phôi còn lại của mô bì còn kẹt lại trong hệ thần kinh trung ương trong giai đoạn đóng ống thần kinh. Vị trí thường gặp nhất là ở đường giữa trên lều hoặc ở góc tiểu não – cầu não. Về mô học, u gồm nhiều thành phần của da bao gồm phần trên của da, nang lông, tuyến mồ hôi; thường bị vôi hóa. Điều trị bằng phẫu thuật cắt bỏ.
Các u sọ hầu (Craniopharyngiomas) được cho rằng phát sinh từ túi Rathke còn sót lại, là tổ chức trung phôi bì do thùy trước tuyến yên phân chia tạo ra. U sọ hầu điển hình gặp ở trên hố yên. Do vị trí như vậy nên có thể biểu hiện triệu chứng chậm phát triển ở trẻ em hoặc rối loạn nội tiết ở người lớn, hoặc giảm thị lực ở cả hai nhóm. Về mô học, u sọ hầu giống với u dạng biểu bì; thường dạng nang, và 80% ở nguời lớn có vôi hóa. Điều trị bằng phẫu thuật cắt bỏ; nếu phẫu thuật không cắt bỏ hoàn toàn thì làm them xạ trị tia bên ngoài sau phẫu thuật hoặc xạ phẫu định vị ba chiều.
Các u nang dạng nhầy (Colloid cysts) là u lành tính không rõ nguồn gốc tế bào xuất hiện trong não thất ba và có thể làm tắc nghẽn dịch não tủy. Các khối u não nguyên phát lành tính khác bao gồm u tế bào thần kinh (neurocytomas), u dưới màng nội tủy (subependymomas), u sao bào vàng đa hình (pleomorphic xanthoastrocytomas). Phẫu thuật cắt bỏ các khối u này là điều trị ban đầu và có thể chữa khỏi.
CÁC HỘI CHỨNG THẦN KINH DA
Nhóm này gồm các rối loạn di truyền, còn gọi là phakomatoses (bẩm sinh), gây nên một loạt phát triển bất thường của da kèm theo tăng nguy cơ u hệ thần kinh trung ương (Bảng 374-1). Các rối loạn này di truyền theo tính trội với mức độ thâm nhập thay đổi.
U xơ thần kinh loại 1 (Neurofibromatosis Type 1 - Bệnh Von Recklinghausen)
U xơ thần kinh loại 1 đặc trưng bởi các u xơ thần kinh trên da, các tổn thương da được gọi là các đốm màu cà phê sữa (café au lait spots), đốm sắc tố trên vùng da không tiếp xúc trực tiếp với ánh mặt trời như nách, u mô thừa (hamartomas) ở mống mắt còn gọi là nốt Lisch (Lisch nodules), và khớp giả của xương chày. U xơ thần kinh là u xơ thần kinh ngoại vi lành tính cấu tạo bởi các tế bào Schwann tăng sản và các nguyên bào sợi. Biểu hiện nhiều khối u mềm trên da có thể sờ thấy. Thường thì không có triệu chứng; tuy nhiên, nếu u phát triển ở những không gian kín, ví dụ lỗ gian đốt sống, nó có thể gây các triệu chứng chèn ép thần kinh hoặc rễ thần kinh. Hẹp cống não với não úng thủy, vẹo cột sống, chiều cao thấp, tăng huyết áp, động kinh và chậm phát triển tinh thần cũng có thể xảy ra.
Bệnh nhân u xơ thần kinh loại 1 có nguy cơ cao mắc các u thần kinh trung ương, bao gồm u thần kinh dạng đám rối (plexiform neurofibromas), u thần kinh đệm đường thị giác (optic pathway gliomas), u tế bào màng ống nội tủy (ependymomas), u màng não (Meningiomas), u tế bào hình sao (astrocytoma), và u tế bào ưa crôm (pheochromocytomas). U xơ thần kinh có thể thoái hóa ác tính thứ phát và trở thành ung thư (sarcoma).
Biến đổi gen ở u xơ thần kinh loại 1 trên nhiễm sắc thể số 17 gây ra bệnh Von Recklinghausen. Gen u xơ thần kinh loại 1 là loại gen áp chế khối u; nó giải mã một loại proteine, là neurofibromin, điều khiển tín hiệu tải nạp thông qua con đường ras GTpase.
U xơ thần kinh loại 2 (Neurofibromatosis Type 2)
U xơ thần kinh loại 2 đặc trưng bởi sự phát triển của u thần kinh thính giác hai bên (Billateral vestibular schwannomas) trong hơn 90% người di truyền gen. Bệnh nhân u xơ thần kinh loại 2 cũng có khuynh hướng mắc u màng não (meningiomas), u thần kinh đệm (gliomas), và u bao sợi thần kinh (schwannomas) của thần kinh tủy sống và thần kinh sọ não. Hơn nữa, bệnh nhân u xơ thần kinh loại 2 còn mắc đục thủy tinh thể, mờ thủy tinh thể dưới bao sau tuổi thanh niên. Hiếm khi xảy ra các đốm màu cà phê sữa và triệu chứng u xơ thần kinh ngoại vi.
Ở bệnh nhân u xơ thần kinh loại 2, u thần kinh thính giác thường kèm theo điếc tiến triển một bên khi ngoài ba muơi tuổi. Thông thường thì chụp cộng hưởng từ có thể phát hiện u thần kinh thính giác hai bên vào thời điểm này (Hình 374-6). Điều trị phẫu thuật khối u tiềm ẩn và bảo tồn thính giác càng nhiều càng tốt.
Triệu chứng này do đột biến gen u xơ thần kinh loại 2 trên nhiễm sắc thể 22q. Gen u xơ thần kinh loại 2 giải mã một loại proteine, là neurofibromin 2, hay schwannomin, hoặc merlin, đồng đẳng với nhóm proteine khung tế bào bao gồm moesin, ezrin, và radixin.
Xơ cứng củ (Tuberous Sclerosis – Bệnh Bourneville)
Xơ cứng như củ đặc trưng bởi tổn thương da, động kinh, và chậm phát triển tâm thần. Các tổn thương da bao gồm u tuyến bã (u xơ mạch ở mặt), những dát giảm sắc tố màu tro hình lá (quan sát tốt nhất khi chiếu tia cực tím bằng đèn Wood), các mảng da nhám (da dày màu hơi vàng nổi trên da ở vùng thắt lưng cùng và các bớt bạc màu. Chẩn đoán đặc hiệu bằng chẩn đoán hình ảnh có sự hiện diện của các nốt dưới màng não thất, có thể thấy vôi hóa. Bệnh nhân xơ cứng củ có nguy cơ cao mắc u tế bào màng ống nội tủy (ependymomas) u tế bào hình sao ở trẻ em (childhood astrocytoma), trong đó hơn 90% là u tế bào hình sao khổng lồ dưới màng não thất (subependymal giant cell astrocytoma). Các u lành tính này có thể phát triển trong võng mạc hoặc dọc bờ của não thất bên. U có thể làm tắc nghẽn lỗ gian não thất (lỗ Monro) và gây tràn dịch não. U cơ tim (rhabdomyomas of myocardium) và u cơ mạch (angiomyomas) ở thận, gan, thượng thận, và tụy cũng có thể xảy ra.
Điều trị theo triệu chứng. Điều trị chủ yếu là thuốc chống co giật đối với động kinh, nối thông đối với tràn dịch não và các chiến lược giáo dục và hành vi đối với chậm phát triển tâm thần. Các trường hợp nặng thường chết trước 30 tuổi.
Trong xơ cứng củ, đột biến hoặc ở gen TSC-1 tại vị trí 9q hoặc gen TSC-2 tại 16p. Những gen này giải mã tuberin, một loại protein điều khiển các hoạt động GTPase của các protein truyền tin tế bào khác.
Hội chứng Von Hippel - Lindau
Hội chứng này bao gồm u nguyên bào mạch máu ở võng mạc, tiểu não, và tủy sống, phát triển chậm thành các u nang. U tế bào thận (hypernephroma), ung thư tế bào thận (renal cell carcinoma), u tế bào ưa crôm (pheochromocytomas), và các nang lành tính của thận, tụy, tinh hoàn, hoặc gan có thể xảy ra. Erythropoietin do u nguyên bào mạch máu tạo ra có thể gây chứng tăng hồng cầu. Đột biến gen Von Hippel – Lindau (VHL) tại nhiễm sắc thể 3p, một gen áp chế khối u, gây nên bệnh này. Gen VHL giải mã một loại protein đa chức năng, bao gồm điều khiển tín hiệu tải nạp đáp ứng với thiếu dưỡng khí tế bào.
CÁC KHỐI U DI CĂN TỚI NÃO
Cơ chế di căn não
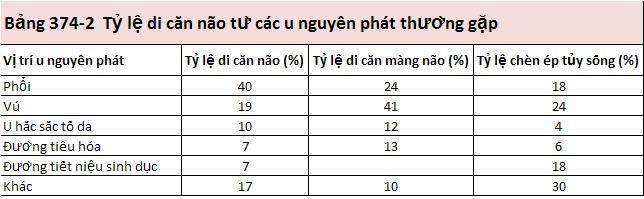
Di căn não phát sinh do lây lan theo đuờng máu. Sự phân bố di căn não theo giải phẫu nói chung song song theo dòng máu não, có xu hướng tập trung vùng giao nhau giữa chất trắng và chất xám và vùng ranh giới phân bố động mạch não giữa và não sau. Phổi là nguồn gốc di căn thuờng gặp nhất; cả ung thư phổi nguyên phát và ung thư di căn phổi đều di căn tới não. Ung thư vú (đặc biệt là ung thư tuyến – ductal carcinoma) có xu hướng di căn tới tiểu não và thùy sau tuyến yên. Các ung thư thường gặp khác xuất phát từ ung thư tiêu hóa và u hắc sắc tố ác tính (u melanin) (Bảng 374-2). Một số ung thư ít gặp khác có xu hướng di căn não là các khối u tế bào mầm và ung thư tuyến giáp. Trái lại, ung thư tiền liệt tuyến, ung thư buồng trứng, và bệnh Hodgkin hiếm khi di căn tới não.
Bảng 374-2:
Tiến triển di căn từ một ung thư đã mắc
Khi chụp cộng hưởng từ (MRI) di căn não điển hình thể hiện là tổn thương gần giống hình cầu có ranh giới rõ, có tín hiệu giảm (hypointense) hoặc đồng tín hiệu (isointense) trên ảnh T1 và sáng trên ảnh T2. Tổn thương này nổi bật rõ với gadolini, do gadolini tràn qua mạch máu khối u do thiếu hàng rào máu não (Hình 374-7). Di căn nhỏ thường đậm đồng nhất. Di căn lớn thường biểu hiện điển hình là một vòng tròn đậm xung quanh một khối mô hoại tử không đậm do khối u phát triển nhanh hơn khả năng cung cấp máu. Một lượng phù nề bao quanh khối di căn. Cũng có thể thấy sản phẩm máu, phản ánh xuất huyết bất thường mạch máu khối u.
Hình 374-7:
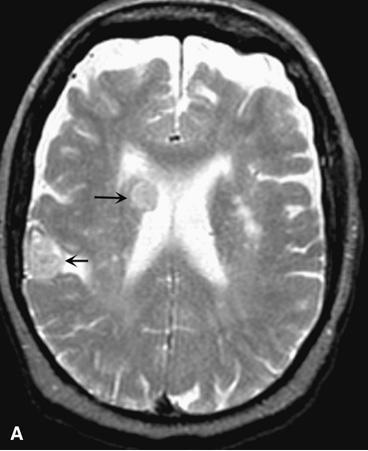
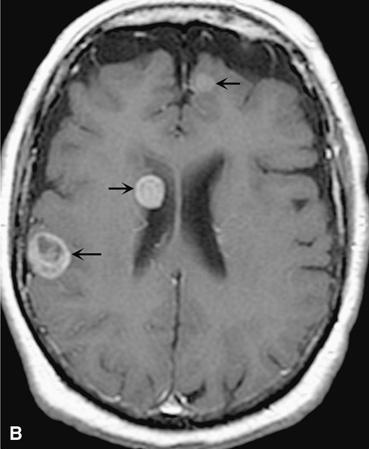
Di căn não. A. Chụp cộng hưởng từ hướng trục T2 tại não thất bên cho thấy hai khối đồng tỷ trọng, một ở dưới màng não thất, một gần vỏ (mũi tên). B. Chụp cộng hưởng từ cản quang sau T1 tại mức tương tự như A cho thấy hai khối u thấy khi chụp T2 cũng như thấy khối u thứ ba tại thùy trán bên trái (mũi tên).
X quang di căn não không đặc hiệu. Chẩn đoán phân biệt vòng tổn thương bao gồm áp-xe não, hoại tử bức xạ, bệnh toxoplasmosis,u hạt (granulomas), lao, bệnh sacoit (sarcoidosis), các tổn thương hủy hoại myeline (demyelinating lesions), các u não nguyên phát, u lym-phô thần kinh trung ương nguyên phát, đột quỵ, chảy máu và chấn thương. Chụp cắt lớp có cản quang ít nhạy cảm bằng chụp cộng hưởng từ để phát hiện di căn não. Không chỉ định xét nghiệm tế bào dịch não tủy do tế bào di căn trong nhu mô não hiếm khi rơi vào dịch não tủy.
Di căn não không rõ ung thư nguyên phát
Tới một phần ba tổng số bệnh nhân trong bệnh viện đa khoa bị di căn não mà không phát hiện ung thư trước đó. Những bệnh nhân này thường biểu hiện hoặc co giật hoặc một suy giảm thần kinh tiến triển. Chẩn đoán hình ảnh não điển hình biểu hiện một hoặc nhiều tổn thương tròn đậm. Ở những người không bị suy giảm miễn dịch, hoặc không có nguy cơ áp-xe não, đặc điểm quang tuyến này rất có thể do di căn não.
Chẩn đoán tiến hành bằng việc tìm kiếm các khối u nguyên phát. Xét nghiệm máu bao gồm kháng nguyên ung thư phổi và chức năng gan. Nên thăm khám da tìm u hắc sắc tố và u tuyến giáp. Thường phát hiện ung thư phổi (đặc biệt là ung thư phổi tế bào nhỏ) hoặc u hắc sắc tố. 30% bệnh nhân không tìm ra khối u nguyên phát, ngay cả sau khi đánh giá tích cực. Nên chụp cắt lớp (CT) ngực, bụng, khung chậu. Nếu tất cả đều âm tính thì nên tiếp tục chiếu chụp, bao gồm chụp xương, chụp phóng xạ khác, chụp nhũ ảnh, chụp cản quang đường tiêu hóa trên và dưới, đôi khi có hiệu quả.
Chẩn đoán mô là cần thiết. Nếu tìm thấy khối u nguyên phát thì dể tiếp cận để làm sinh thiết hơn so với tổn thương não. Nếu phát hiện tổn thương não duy nhất ở vị trí có thể phẫu thuật, hoặc nếu không tìm thấy khối u não nguyên phát, hoặc khối u nguyên phát ở vị trí khó sinh thiết, nên sinh thiết hoặc cắt bỏ di căn não.
Điều trị các khối u di căn tới não
Khi ung thư di căn đến não thì hiếm khi chữa khỏi. Do đó, điều trị nhằm phòng ngừa tàn tật và giảm đau đớn, và nếu có thể thì kéo dài sự sống. Các nghiên cứu tập trung vào khả năng sống tại cuối thời điểm u nguyên phát nhưng vẫn chưa trả lời câu hỏi về chất lượng cuộc sống. Tuy nhiên, các thuốc glucocorticoids, thuốc chống co giật, bức xạ trị liệu và phẫu thuật được rộng rãi thừa nhận trong điều trị những bệnh nhân này.
CÁC BIỆN PHÁP TỔNG HỢP
Glucocorticoids thường cải thiện các triệu chứng của di căn não. Hiệu quả nhanh trong vòng 24 giờ, và duy trì hiệu quả nếu tiếp tục sử dụng, mặc dù tích lũy độc tính. Vì vậy, nếu có thể thì tiến hành điều trị với liệu pháp cho phép ngừng điều trị bằng glucocorticoid. Một phần ba số bệnh nhân bị di căn não bị co giật một hoặc nhiều cơn, thuốc chống co giật thường được sử dụng để phòng co giật.
CÁC BIỆN PHÁP ĐẶC HIỆU
Xạ trị
Xạ trị là phương pháp điều trị chính đối với di căn não. Ngoài việc di căn được nhìn thấy trên chẩn đoán hình ảnh, do lắng đọng vi mô ra toàn não bộ của các tế bào khối u nên thường sử dụng xạ trị não toàn bộ (Whole-Brain Radiotherapy - WBRT). Lợi ích của xạ trị não toàn bộ đã được nghiên cứu báo cáo nhưng không chỉ rõ liều đáp ứng được sử dụng. Thường liều sử dụng là 30-37.5 Gy trong 10-15 phân liều; cũng có thể dùng một liều bổ xung (“liều nhắc lại”) chiếu tập trung vào u di căn đơn độc hoặc di căn lớn. Xạ phẫu định vị ba chiều (stereotaxic radiosurgery) có hiệu quả trên bệnh nhân có di căn từ bốn u trở xuống trên chụp cộng hưởng từ. Phối hợp xạ trị não toàn bộ và xạ phẫu định vị ba chiều làm giảm tái phát u trong não nhưng không kéo dài thời gian sống.
Phẫu thuật
Tới 40% tổng số bệnh nhân di căn não chỉ phát hiện một u duy nhất khi chụp cắt lớp. Phẫu thuật cắt bỏ khối u di căn duy nhất ở vị trí có thể tiếp cận là phương pháp tạm thời. Nếu kiểm soát được bệnh toàn thân, cắt bỏ hoàn toàn tổn thương não duy nhất có thể tăng thời gian sống và giảm thiểu tàn tật. Phẫu thuật có kết quả tốt hơn khi xạ trị não toàn bộ sau phẫu thuật.
Hóa trị
Di căn não của một số ung thư nhất định, gồm ung thư vú, ung thư phổi tế bào nhỏ, và ung thư tế bào gốc, thường đáp ứng với hóa trị toàn thân. Mặc dù u di căn thường không đáp ứng tốt bằng các u nguyen phát, nhưng một số trường hợp đáp ứng rất tốt với hóa trị toàn thân và hóc-môn trị liệu. Ở bệnh nhân không có triệu chứng thần kinh, ban đầu có thể hóa trị toàn thân từ hai đến bốn chu kỳ nhằm giảm khối u và đám ứng với xạ trị tốt hơn. Thậm chí, nếu hóa trị làm lui bệnh hoàn toàn thì cũng nên tiến hành xạ trị não toàn bộ. Các liệu pháp gen trị liệu, miễn dịch trị liệu, hóa trị nội mạch, và hóa trị sau khi phá vỡ thẩm thấu của hàng rào máu não đang được thẩm định.
DI CĂN MÀNG NÃO
Di căn màng não tủy mềm, còn gọi viêm màng não do ung thư (carcinomatous meningitis, meningeal carcinomatosis), trong một số trường hợp là viêm màng não bệnh bạch cầu (leukemic meningitis or lymphomatous meningitis). Bằng chứng lâm sàng cho thấy 8% bệnh nhân có u đặc di căn; khi mổ tử thi thì tỷ lệ lên tới 19%. Trong số các u rắn thì ung thư tuyến của vú, phổi, và đường tiêu hóa, và u hắc sắc tố là thường là nguyên nhân gây di căn (Bảng 374-2). Một phần tư bệnh nhân ung thư toàn thân kiểm soát được và có thể kéo dài thời gian sống và chất lượng cuộc sống ở các bệnh nhân kiểm soát tốt.
Ung thư thường di căn màng não qua đường máu. Một cách khác nữa, các tế bào có thể xâm lấn khoang dưới nhện trực tiếp từ bề mặt nhu mô não di căn. Một số ung thư, ví dụ ung thư biểu mô gai (squamous cell carcinoma) của da và một vài lym-phô không Hodgkin (non-Hodgkin's lymphomas) có xu hướng phát triển dọc theo thần kinh ngoại biên và có thể tới màng não theo đường này.
Đặc điểm lâm sàng
Các dấu hiệu và triệu chứng hệ thần kinh trong di căn màng não biểu hiện nhiều mức độ khác nhau, thường gặp biểu hiện toàn thân ác tính. Triệu chứng não thường gặp. Đặc trưng là các triệu chứng thần kinh sọ hoặc rễ thần kinh tủy sống do bị chèn ép gốc rễ thần kinh. Có thể gặp não úng thủy nếu dịch não tủy bị tắc nghẽn. Các triệu chứng thần kinh khu trú phản ánh sự tồn tại đồng thời của di căn trong não.
Chẩn đoán hình ảnh và xét nghiệm
Di căn màng não được chẩn đoán bằng xét nghiệm có tế bào ác tính trong dịch não tủy, bằng biểu hiện lắng đọng u dạng nốt hoặc tăng lan tỏa trong màng não trong chụp cộng hưởng từ (Hình 374-8), và bằng sinh thiết màng não. Dịch não tủy thường biểu hiện tăng lym-phô bào, tăng nồng độ protein, nồng độ đường bình thường hoặc giảm. Xét nghiệm tế bào dịch não tủy dương tính khi có bằng chứng rõ rệt tế bào khối u đã vào khoang dưới nhện. Kết quả xét nghiệm dịch não tủy có ý nghĩa hơn khi lấy nhiều dịch não tủy và làm xét nghiệm tới ba lần. Chỉ định chụp cộng hưởng từ toàn bộ trục não tủy trong mọi trường hợp nghi ngờ di căn màng não; ngoài tổn thương màng não dạng nốt, có thể thấy não úng thủy trong trường hợp tắc nghẽn dịch não tủy.
Hình 374-8:
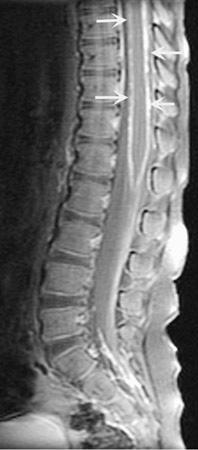
Viêm màng não do ung thư (carcinomatous meningitis). Chụp cộng hường từ cắt dọc sau cản quang vùng dưới ngực biểu hiện đậm cản quang lan tỏa trên màng mềm dọc theo bề mặt tủy sống (mũi tên), điển hình của lây lan ung thư theo dịch não tủy.
Điều trị di căn màng não
Mặc dù tiên lượng bệnh nhân di căn màng não rất xấu, khoảng 20% bệnh nhân được điều trị tích cực có đáp ứng trên hoặc bằng 6 tháng. Liệu pháp tiêm hóa chất vào khoang nội tủy (intrathecal therapy) làm tập trung hóa trị vào khối u màng não và giảm thiểu nhiễm độc toàn thân. Methotrexate có thể được dùng tiêm nội tủy an toàn và có hiệu quả chống lại di căn màng não từ các khối u rắn bao gồm ung thư bạch huyết (u lym-phô - lymphoma); cytarabine và thiotepa là hóa chất thay thế. Liposomal cytarabine chỉ được dùng 2 tuần một lần do kéo dài tác dụng gây độc tế bào của cytarabine trong dịch não tủy ; trái lại các thuốc khác dùng 1 tuần một lần hoặc 2 lần một tuần. Tiêm nội tủy bằng cách chọc ống sống thắt lưng hoặc bằng cấy ống Ommaya, ống này nối với não thất từ một ống được cấy dưới da đầu. Nếu có nghi ngờ đường dịch não tủy hở, có thể tiến hành nghiên cứu dòng phóng xạ hạt nhân qua ống này.
Lắng đọng u thể nốt lớn trên màng não và dọc theo rễ thần kinh ít đáp ứng với hóa trị do khếch tán hạn chế. Do đó nên chiếu xạ tia bên ngoài (external beam radiation), và có thể có hiệu quả khi hóa trị toàn thân. Não úng thủy điều trị bằng dẫn lưu não thất – ổ bụng (ventriculoperitoneal shunt), mặc dù có nguy cơ tế bào ung thư lan xuống màng bụng.
CHÈN ÉP TỦY SỐNG ÁC TÍNH
Chèn ép tủy sống từ khối u rắn di căn do u di căn cột sống phát triển vào khoang ngoài màng cứng. Các ung thư nguyên phát thường di căn xương là ung thư phổi, vú, và tuyến tiền liệt. Đau lưng là triệu chứng đầu tiên và gặp ở 90% bệnh nhân. Điển hình là đau âm ỉ, và có thể kèm theo yếu tại chỗ. Có đau rễ thần kinh nếu gốc thần kinh bị chèn ép. Cột sống ngực thường gặp nhất. Yếu, mất cảm giác, rối loạn thần kinh thực vật (autonomic dysfunction) (tiểu gấp, tiểu không tự chủ, ỉa đùn, và bất lực ở nam giới) là những dấu hiệu của chèn ép tủy sống. Khi các dấu hiệu chèn ép tủy sống xuất hiện, nó có xu hướng tiến triển rất nhanh. Vì vậy, điều căn bản là phải nhận ra và điều trị các biến chứng ác tính nghiêm trọng này nhanh chóng để phòng ngừa các triệu chứng suy giảm thần kinh không hồi phục.
DI CĂN TỚI HỆ THỐNG THẦN KINH NGOẠI BIÊN
Ung thư có thể chèn ép hoặc xâm lấn thần kinh ngoại biên. Chèn ép đám rối thần kinh cách tay có thể gặp do chèn ép trực tiếp của khối u Pancoast (ung thư đỉnh phổi), ung thư lym-phô, hoặc do di căn hạch bạch huyết tại chỗ phát triển trong ung thư vú hoặc phổi. Đám rối thần kinh thắt lưng-cùng có thể bị khối u sau màng bụng chèn ép xâm lấn chẳng hạn trong ung thư tiền liệt tuyến và ung thư buồng trứng hoặc ung thư lym-phô. Di căn sọ não có thể chèn ép các nhánh dây thần kinh sọ não khi chui vào sọ não, và ung thư di căn tuyến yên có thể xâm lấn xoang hang.
Bao ngoải bó thần kinh thường bảo vệ sự xâm lấn của khối u rắn đối với thần kinh ngoại biên, nhưng một số ung thư xâm lấn và lan dọc theo thần kinh ngoại biên. U hắc sắc tố của da có thể lan dọc theo dây thần kinh sinh ba và lan rộng trong sọ. U lym-phô không Hodgkin có thể hướng thần kinh và gây viêm đa rễ thần kinh (polyradiculopathy) hoặc gây hội chứng giống bệnh một dây thần kinh nhiều nơi (mononeuropathy multiplex). Chiếu xạ tia bên ngoài tập trung có thể giảm đau, phòng ngừa mất chức năng thần kinh ngoại biên không hồi phục, và có thể phục hồi được chức năng.
Ở bệnh nhân ung thư đám rối cánh tay và thắt lưng cùng, có thể khó phân biệt ung thư xâm lấn với tổn thương do chiếu xạ. Chiếu xạ liều cao hoặc có chứng rung cơ cục bộ có thể nghĩ đến tổn thương do chiếu xạ, trong khi đau thì nghĩ tới khối u. Chụp X quang có kết quả không chắc chắn và đôi khi cần phẫu thuật thăm dò.
CÁC BIẾN CHỨNG ĐIỀU TRỊ
Nhiễm độc bức xạ
Hệ thống thần kinh có thể bị tổn thương do bức xạ trị liệu. Về mặt mô học, đó là sự mất myêlin, thoái hóa các mạch máu nhỏ, và cuối cùng là nhồi máu não và hoại tử não.
Tổn thương bức xạ não cấp tính xảy ra trong hoặc ngay sau điều trị. Hiếm khi thấy khi dùng chiếu xạ tia bên ngoài (external beam radiation) nhưng có thể xảy ra sau xạ phẫu định vị ba chiều (stereotaxic radiosurgery). Các biểu hiện bao gồm đau đầu, mất ngủ, và làm các triệu chứng thần kinh trước đó trầm trọng thêm.
Tổn thương bức xạ sớm xảy ra trong vòng 4 tháng điều trị. Nó kèm theo dấu hiệu tăng chất trắng T2 trên chụp cộng hưởng từ. Ở trẻ em, hội chứng buồn ngủ (somnolence syndrome) là thể bệnh thường gặp của tổn thương bức xạ giai đoạn sớm trong đó buồn ngủ và thất điều xuất hiện sau xạ trị não toàn bộ - WBRT. Bức xạ đốt sống cổ có thể gây hiện tượng Lhermitte, một cảm giác điện giật do cổ gục. Các triệu chứng do tổn thương bức xạ sớm và cấp tính thường đáp ứng với điều trị glucocorticoid, có thể kiểm soát được, và thường hết mà không để lại triệu chứng thần kinh. Các tổn thương này không làm tăng nguy cơ tổn thương bức xạ muộn.
Tổn thương bức xạ muộn gây tổn thương vĩnh viễn hệ thần kinh. Nó xảy ra sau 4 tháng (nói chung từ 8-24 tháng) sau khi điều trị kết thúc; có trường hợp rất muộn sau 15 năm điều trị. Sau chiếu xạ não khu trú, hoại tử bức xạ có thể xảy ra trong khu vực chiếu xạ, tạo nên khối cản quang đậm (thường hình tròn) với những dấu hiệu chất trắng bất thường xung quanh (Hình 374-9). Chụp cộng hưởng từ và chụp cắt lớp thường không phân biệt được hoại tử bức xạ từ khối u tái phát, nhưng chụp PET (Positron Emission Tomography - chụp cắt lớp phát xạ Positron) hoặc chụp SPECT (Single Photon Emission Computed Tomography – chụp cắt lớp phát xạ Photon đơn) có thể biểu hiện tăng chuyển hóa glucose điển hình của tổ chức khối u hoặc giảm chuyển hóa của mô hoại tử. Ghi hình phổ cộng hưởng từ (Magnetic Resonance Spectroscopy - MRS) có thể biếu hiện mật độ lactate cao cùng với mật độ choline tương đối thấp trong khu vực hoại tử. Thường cần sinh thiết để chẩn đoán chính xác. Các thần kinh ngoại vi, bao gồm đám rối thần kinh cánh tay và đám rối thần kinh thắt lưng – cùng, có thể có tổn thương bức xạ muộn.
Hình 374-9:
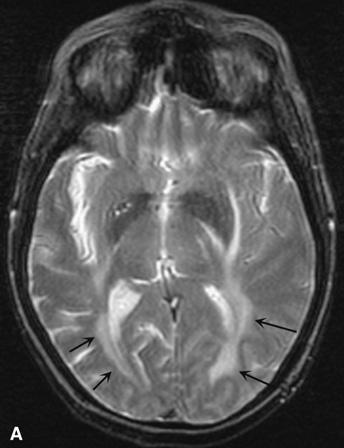
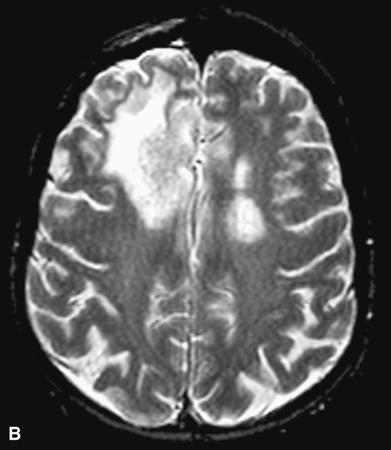
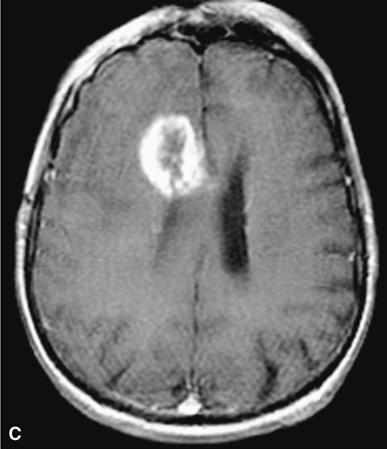
Tổn thương bức xạ. A. Tổn thương bức xạ muộn 1 năm sau xạ trị não toàn bộ (5500 cGy). Chụp cộng hưởng từ T2 tại mức thùy thái dương cho thấy dấu hiệu đậm bất thường chất trắng quanh não thất (mũi tên). B và C. Hoại tử bức xạ tập trung 3 năm sau xạ trị (7000 cGy) đối với ung thư mũi-hầu. Chụp cộng hưởng từ hướng trục (B) cho thấy một khối ở thùy trán bên phải xung quanh có phù giãn mạch. Các dấu hiệu thay đổi bất thường cũng có ở bên trái. Chụp cộng hưởng từ cản quang sau T1 (C) cho thấy một khối không đồng nhất ở hồi đai bên phải (right cingulate gyrus).
Nếu không được điều trị, hoại tử bức xạ của thần kinh trung ương có thể hoạt động như một tổn thương hàng loạt mở rộng. Các triệu chứng này có thể tự mất hoặc đáp ứng với điều trị bằng glucocorticoid. Hoại tử bức xạ tiến triển tốt nhất điều trị bằng phẫu thuật cắt bỏ nếu bệnh nhân sống được hơn 6 tháng và điểm số Karnofsky lớn hơn 70. Có những báo cáo chưa được kiểm chứng cho rằng thuốc chống đông máu như heparin hoặc warfarin có thể có hiệu quả. Sau xạ trị não toàn bộ (WBRT), sa sút trí tuệ tiến triển có thể xảy ra, kèm theo đi lết (gait apraxia) và tiểu không tự chủ. Tổn thương bức xạ các động mạch lớn cũng làm tăng phát triển xơ vữa động mạch, nhưng nguy cơ đột quỵ chỉ tăng sau vài năm xạ trị.
Rối loạn chức năng nội tiết xảy ra sau khi suy giảm chức năng tuyến yên do vùng dưới đồi hoặc tuyến yên phơi nhiễm với xạ trị. Hóc-môn tăng trưởng của tuyến yên là hóc-môn nhạy cảm nhất đối với xạ trị; hóc-môn kích thích tuyến giáp (TSH) ít nhạy cảm nhất; ACTH, prolactin, và gonadotropins (hóc-môn hướng dục) nhạy cảm trung bình.
Phát triển một khối u thứ hai là một nguy cơ bức xạ trị liệu thường xảy ra sau nhiều năm phơi nhiễm bức xạ. Tùy thuộc vào lĩnh vực chiếu xạ, các nguy cơ u tế bào đệm (gliomas), u màng não (meningiomas), ung thư mô liên kết (sarcomas), và ung thư tuyến giáp sẽ tăng lên.
Nhiễm độc hóa trị
Các phác đồ hóa trị sử dụng điều trị các u não nguyên phát nói chung chứa các tác nhân alkyl hóa (alkylating agents), temozolomide hoặc nitrosoureas, dung nạp tương đối tốt. Hiếm khi thuốc sử dụng điều trị ung thư hệ thần kinh trung ương làm xuất hiện các trạng thái biến đổi tâm thần (lẫn, trầm cảm), thất điều, và co giật. Hóa trị để điều trị ung thư ác tính toàn thân thường gây nhiễm độc hệ thống thần kinh hơn và thường gây nhiễm độc hệ thống thần kinh ngoại vi hơn là hệ thống thần kinh trung ương. Cisplatin thường gây ù tai và điếc tần số cao cả hai tai, đặc biệt ở những bệnh nhân trẻ hơn. Ở liều tích lũy >450 mg/m2, cisplatin có thể gây ra bệnh thoái hóa thần kinh sợi lớn đối xứng (large-fiber axonal neuropathy) hầu hết trên thần kinh cảm giác; paclitaxel (Taxol) cũng tương tự. Fluorouracil và cytarabine liều cao có thể gây rối loạn chức năng tiểu não, sẽ hết sau khi ngưng điều trị. Vincristine, thường được dùng để điều trị u lym-phô, cũng có thể gây tắc ruột cấp và thường kèm theo bệnh thần kinh vận động cảm giác đầu chi đối xứng tiến triển có liệt bàn chân và dị cảm.
Dịch từ nguyên bản tiếng Anh - Primary and Metastatic Tumors of the Nervous System, Stephen M. Sagar & Mark A. Israel, Harrison’s Principle of Internal Medicine, 17th Edition bởi healthconsul@gmail.com tại Dulichchuabenh.vn
Tải xuống bản pdf đầy đủ